
某待测溶液中可能含有Ag+、Fe3+、Na+、Mg2+、Ba2+、Al3+等离子,进行如下实验:①加入过量的稀盐酸,有白色沉淀生成。②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀。③过滤,取少量滤液,滴入KSCN溶液,没有明显的现象出现。④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,无明显现象。⑤另取少量步骤④反应后的溶液,焰色反应呈黄色。根据实验现象回答:
(1)待测液中一定含有的离子是 。
(2)待测液中一定不含有的离子是 。
(3)待测液中不能确定是否存在的离子是 ,要检测这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程) 。
(每空2分) (1)Ag+、Ba2+ (2)Fe3+、Mg2+ 、Al3+
(3)Na+ 取原待测液做焰火反应实验,焰色反应呈黄色,证明待测液中含有Na+
解析试题分析:加入过量的稀盐酸,有白色沉淀生成,说明溶液中含有Ag+。过滤,在滤液中加入过量的稀硫酸,又有白色沉淀,这说明溶液中还含有Ba2+。过滤,取少量滤液,滴入KSCN溶液,没有明显的现象出现,说明溶液中不存在Fe3+。另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,无明显现象,这说明溶液中没有Mg2+ 、Al3+。另取少量步骤④反应后的溶液,焰色反应呈黄色,说明含有钠离子。但由于在实验过程中加入了氢氧化钠溶液,所以不能确定是否含有钠离子。要检测是否含有钠离子,正确的实验操作是取原待测液做焰火反应实验,焰色反应呈黄色,证明待测液中含有Na+。
考点:考查物质检验和鉴别的有关实验判断
点评:该题是中等难度的试题,也是高考中的常见题型,试题综合性强,侧重对学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。该题还需要注意的是在进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。


科目:高中化学 来源: 题型:填空题
有以下几种物质 ①碳酸氢钠晶体;②液态氯化氢;③铁;④蔗糖;⑤乙醇;⑥熔融的K2SO4;⑦干冰;⑧石墨;⑨氨气。填空回答:(填序号)
(1)以上物质能导电的是 。
(2)以上物质中属于电解质的是 。
(3)以上物质中属于非电解质的是 。
(4)以上物质中溶于水后水溶液能导电的是 。
(5)分别写出物质①、⑥在水溶液中的电离方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:______________________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)某无色溶液可能存在如下离子:Ag+、Ba2+和由上推出的元素组成的离子E+、F3+、FD2―、G2―、BD32―、GD32―、GD42―,现取该溶液进行有关实验,结果如下图所示。
①生成淡黄色沉淀的离子方程式为 。
②由溶液甲生成沉淀乙的离子方程式 。
③综合上述信息,可以肯定存在的离子有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是 。
(2)D的化学式为_________,D溶液显碱性的原因是(用离子方程式表示):
。
(3)E和氨水反应的离子方程式是___________________________________ _____。
(4)设计实验检验B中所含的阳离子:
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强。工业上往往采取下列循环工艺防止铬的污染: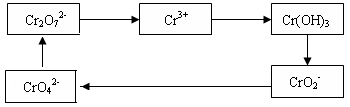
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
Cr2O72- + Fe3O4 + H+ → Cr3+ + Fe3+ + H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目。
(2)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。写出从该沉淀中分离出Cr(OH)3的离子方程式 、
。
(3)回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I-
准确称取纯净的K2Cr2O7 0.1225g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为 (保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列个问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称)
(2)催化氧化阶段反应2SO2(g)+O2(g)  2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。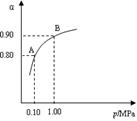
理论上要提高SO2的转化率,反应的条件应是 温 、高压(填“高”、“低”、或“常” ),但通常情况下工业生产中采用常压的原因是 。
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。该反应的平衡常数等于 。
(3)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。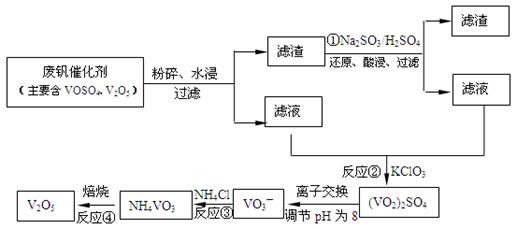
则:反应①②③④中属于氧化还原反应的是 (填数字序号),反应③的离子方程式为 。该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。 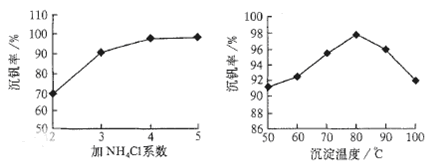
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3 g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。
另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)试通过计算确定该结晶水合物的化学式为 ;
(2)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0 mol·L-1。
①加入少量Ba(OH)2溶液,则反应的离子方程式为 ;
②加入一定量的Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为 ;
③若加入75 mL的Ba(OH)2溶液,则得到的沉淀质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铁溶于一定浓度的硝酸时,发生反应的离子方程式为:
aFe+bNO3-+cH+═dFe2++fFe3++gNO↑+hNO2↑+kH20,下列有关推断中,不正确的是( )
| A.2d+3f=3g+h |
| B.c+b=2d+3f |
| C.HNO3的氧化性强于Fe3+ |
| D.反应中每消耗5.6gFe,转移0.2mol~0.3mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于反应3Cl2+6NaOH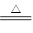 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C.氧化剂得电子总数与还原剂失电子总数之比为1∶1 |
| D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com