
【题目】下列各组物质,按氧化物、混合物、单质、电解质顺序排列的是
A. 二氧化硫 、碘酒 、液态氧 、烧碱
B. 硫酸钾 、纯碱 、白磷 、生石灰
C. 氧化铜 、氯化氢 、钠 、干冰
D. 氧化钙 、胆矾 、氮气 、空气
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W,X,Y,Z在元素周期表中的位置如图所示.下列说法中,正确的是( ) 
A.W的最高价氧化物对应的水化物是强酸
B.Y的原子半径在同周期主族元素中最大
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是( )
A. 常温下所有的金属都是固态
B. 金属具有导电、导热和延展性
C. 金属都具有较高的硬度和密度
D. 金属都具有较高的熔点和沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缩醛在有机合成中常用于保护羰基或作为合成中间体,同时还是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。下面是G的一种合成路线:
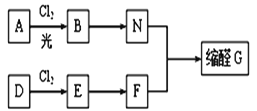
已知:①芳香烃A含氢元素的质量分数为8.7%,A的质谱图中,分子离子峰对应的最大质荷比为92; D的产重可以用来衡量一个国家的石油化工发展水平。
②同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
③
回答下列问题:
(1)A的结构简式是_____________________,E的名称是____________________________。
(2)由D生成E的反应类型是________,E→F的反应条件是_________________________。
(3)由B生成N的化学方程式为___________________________。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉、效率高、污染物少的优点。维生素C的结构如右图。则维生素C分子中含氧官能团名称为_____________。

(5)缩醛G的结构简式为______________。G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式:_________________________。
①既能发生银镜反应,又能与FeC13发生显色反应;②核磁共振氢谐为4组峰。
(6)写出用2-丁烯为原料(其他无机试剂任选)制备顺丁橡胶(顺式聚1,3-丁二烯)的合成路线:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌冶炼过程中会产生大量的铅浮渣,其主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。利用铅浮渣生产硫酸铅的流程如下。下列说法不正确的是

A. 步骤Ⅰ中反应的离子方程式是:Pb+4H++2NO=Pb2++2NO↑+2H2O
B. 复分解反应的方程式是:Pb(NO3)2+H2SO4= PbSO4↓+2HNO3
C. 为保证产品纯度,需控制硝酸的量以为防止Ag被溶解
D. 步骤Ⅱ得到的粗产品PbSO4 含有少量CaSO4杂质,还需用Pb(NO3)2溶液多次洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0molL﹣1NaOH溶液反应,用去35mL碱液时恰好完全中和.试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10mL原混合液,加入3.2g铜粉共热时,在标准状况下收集到气体的体积为多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com