
【题目】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______mol/L。
【答案】 2.67(8/3) 40% c d 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1 1.4×10-3 1 ×10-5
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1 1.4×10-3 1 ×10-5
【解析】试题分析:(1)利用“三段式”计算NO2(g)+SO2(g)![]() SO3(g)+NO(g) 的平衡常数;(2)①有害气体NO的转化率=NO的变化量÷NO的初始量×100%;②根据影响化学平衡的因素进行判断;(3)根据盖斯定律计算NO2与CO的反应热;(4)根据Kb=
SO3(g)+NO(g) 的平衡常数;(2)①有害气体NO的转化率=NO的变化量÷NO的初始量×100%;②根据影响化学平衡的因素进行判断;(3)根据盖斯定律计算NO2与CO的反应热;(4)根据Kb=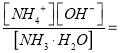 2.0 ×10-5计算c(OH-);
2.0 ×10-5计算c(OH-);
解析:(1)将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中,设开始时NO2的浓度为amol/L,则SO2的浓度为2amol/L;NO2浓度变化为xmol/L;
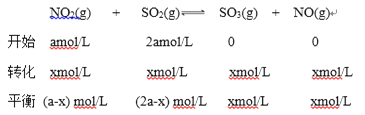
(a-x) mol/L:(2a-x) mol/L=1:6;
x=0.8a
![]() ;
;
(2)①将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,NO、CO的浓度分别是1 mol/L、1.2mol/L,根据图示,平衡时CO浓度的变化量为0.4 mol/L,则有害气体NO的浓度变化量是0.4 mol/L,NO的转化率是![]() ;
;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,但平衡时CO浓度大于第一次平衡浓度,故a错误; b.增加CO的量,平衡向正反应方向移动,但CO的浓度增大,故b错误; c.降低温度,平衡向正反应方向移动,则CO的浓度减小,故c正确;d.扩大容器体积,压强减小,平衡向逆反应方向移动,但平衡时CO浓度小于第一次平衡浓度,故d正确;
(3)CO的燃烧热△H=-c kJ·mol-1,即①CO(g)+![]() O2(g)= CO2(g)△H=-c kJ·mol-1 。
O2(g)= CO2(g)△H=-c kJ·mol-1 。
② 2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;
③ 2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1;
N2(g)+2CO2(g) △H=-a kJ·mol-1;
根据盖斯定律,③-②+①×2得 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1;
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1;
(4)①根据Kb=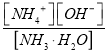
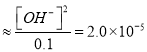 ,c(OH-)=1.4×10-3;
,c(OH-)=1.4×10-3;
②若向其中加入固体NH4Cl,氯化铵抑制氨水电离, ![]() 接近0.1mol/L,根据
接近0.1mol/L,根据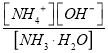 =2.0 ×10-5,
=2.0 ×10-5, ![]() 2.0 ×10-5, c(OH-)=1×10-5。
2.0 ×10-5, c(OH-)=1×10-5。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,用化学用语回答下列有关问题: 
(1)⑧的原子结构示意图为:;
(2)②和③气态氢化物稳定性大小顺序是:(写化学式);
(3)③、⑧、⑩的最高价含氧酸的酸性最强的是:(写化学式);
(4)实验室制取③的气态氢化物的化学方程式为
③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是(写化学式),它属于(选填“共价化合物”或“离子化合物”)
(5)①、④、⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电式式为:
(6)欲比较④和⑨两种元素非金属性强弱,可以做为验证的证据是(填序号).
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按氧化物、混合物、单质、电解质顺序排列的是
A. 二氧化硫 、碘酒 、液态氧 、烧碱
B. 硫酸钾 、纯碱 、白磷 、生石灰
C. 氧化铜 、氯化氢 、钠 、干冰
D. 氧化钙 、胆矾 、氮气 、空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铁、石墨、稀盐酸组成的原电池工作时,下列叙述正确的是( )
A. 铁电极为负极 B. 石墨电极为负极
C. 氢离子向铁电极移动 D. 正极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酒精说法错误的是
A.医用消毒酒精中乙醇的体积分数为75%
B.向空气中喷洒大量酒精进行消毒,存在安全隐患
C.工业酒精因含甲醇故不能勾兑直接饮用
D.酒精与84消毒液混合,可增强消毒效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液2a L分成两等份.一份加入bmol NaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3﹣的浓度为( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾.检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(1)该反应中氧化剂是(填化学式).
(2)用双线桥表示该反应电子转移的方向和数目.
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为 .
(4)利用上述反应检验食盐中是否加碘,所需试剂是(填选项序号).
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示

回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为 。
(2)酸浸时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为 。
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是 。
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X为 ,反应的离子方程式为 。
(5)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为 。
(6)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.76 kJ·mol-1,自发进行的原因是
A.吸热反应B.放热反应C.熵减少的反应D.熵增大效应大于热效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com