
【题目】(14分)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示

回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为 。
(2)酸浸时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为 。
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是 。
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X为 ,反应的离子方程式为 。
(5)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为 。
(6)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
【答案】(1)Fe2O3+3CO![]() 2Fe+3CO2 (2) 4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O
2Fe+3CO2 (2) 4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O
(3)防止NH4HCO3分解
(4)KCl 2K++SO42-=K2SO4↓ (5) 4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
(6)滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液
【解析】
试题分析:(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,因此该气体是CO,则该气体与Fe2O3反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)亚铁离子具有还原性,易被空气中的氧气氧化,因此若在空气中酸浸时间过长,溶液中Fe2+含量将下降,反应的离子方程式为4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O;
(3)碳酸氢铵是弱酸的铵盐,受热易分解,所以温度不能超过35℃的原因是防止NH4HCO3分解;
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X中一定含有钾离子,因此X可以是氯化钾,反应的离子方程式为2K++SO42-=K2SO4↓;
(5)在空气中煅烧,碳酸亚铁被氧化为氧化铁,同时还有CO2生成,反应的方程式为4FeCO3+O2![]() 2Fe2O3+4CO2;
2Fe2O3+4CO2;
(6)产品Ⅱ主要为硫酸钾,为检验是否含有氯化物杂质,应加入硝酸银,但在加入硝酸银之前应加入过量的硝酸钡溶液,以除去硫酸根离子,过滤后再加入硝酸银溶液。


科目:高中化学 来源: 题型:
【题目】缩醛在有机合成中常用于保护羰基或作为合成中间体,同时还是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。下面是G的一种合成路线:
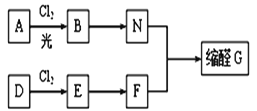
已知:①芳香烃A含氢元素的质量分数为8.7%,A的质谱图中,分子离子峰对应的最大质荷比为92; D的产重可以用来衡量一个国家的石油化工发展水平。
②同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
③
回答下列问题:
(1)A的结构简式是_____________________,E的名称是____________________________。
(2)由D生成E的反应类型是________,E→F的反应条件是_________________________。
(3)由B生成N的化学方程式为___________________________。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉、效率高、污染物少的优点。维生素C的结构如右图。则维生素C分子中含氧官能团名称为_____________。

(5)缩醛G的结构简式为______________。G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式:_________________________。
①既能发生银镜反应,又能与FeC13发生显色反应;②核磁共振氢谐为4组峰。
(6)写出用2-丁烯为原料(其他无机试剂任选)制备顺丁橡胶(顺式聚1,3-丁二烯)的合成路线:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,下图所示为海水综合利用部分流程,有关说法正确的是( )

A. 上述工艺流程中涉及到化合、分解、复分解和置换反应
B. ①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2
C. ③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2
D. ④中反应的离子方程式为SO2+Br2+2H2O===4H++SO42-+2Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.5mol的Y元素的离子得到6.02×1023个电子后被还原成中性Y原子,另外已知0.4gY的氧化物恰好与100mL 0.2molL﹣1 的盐酸完全反应,且Y原子核内质子数和中子数相等.若Y是短周期中某种金属元素.回答下列问题:
(1)Y的名称为 , 它在周期表的位置为;
(2)Y的氧化物与盐酸反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y、Z、W、R为前四周期元素,且原子序数依次增大。X基态原子核外有三个未成对电子,Z、W分别是短周期中电负性最大和最小的元素;R2+离子的3d轨道中有三对成对电子。请回答下列问题:
(1)R基态原子的电子排布式为__________,元素X、Y、Z的第一电离能由大到小的顺序为(用元素符号表示)___________________。
(2)化合物XZ3的空间构型为______,R2+与NH3形成的配离子中,提供孤对电子的是_____。
(3)Z的氢化物由固体变为气态所需克服的微粒间的作用力是________。
(4)Z、W、R形成某种化合物的晶胞结构如右图所示,其化学式为___________。

(5)XY2-能被酸性KMnO4溶液氧化,其中MnO4-被还原为Mn2+,反应的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个定容的密闭容器中进行如下反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。当反应达平衡时可能存在的数据正确的是 ( )
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。当反应达平衡时可能存在的数据正确的是 ( )
A. c(SO2)=0.4 mol·L-1
B. c(O2)=0.2 mol·L-1
C. c(SO2)+c(SO3)=0.15 mol·L-1
D. c(SO3)+c(O2)=0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,合成氨的反应N2+3H2![]() 2NH3,现将2mol N2和2mol H2通入该容器中反应,20s后生成0.8 mol的NH3,则H2的转换率是多少( )
2NH3,现将2mol N2和2mol H2通入该容器中反应,20s后生成0.8 mol的NH3,则H2的转换率是多少( )
A. 70% B. 60% C. 50% D. 40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com