
【题目】我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾.检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(1)该反应中氧化剂是(填化学式).
(2)用双线桥表示该反应电子转移的方向和数目.
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为 .
(4)利用上述反应检验食盐中是否加碘,所需试剂是(填选项序号).
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液.
【答案】
(1)KIO3
(2)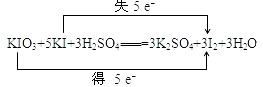
(3)0.12mol
(4)②③④
【解析】解:(1)KIO3中I元素的化合价降低,则KIO3为氧化剂,故答案为:KIO3;
(2.)氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,化合价升高值=化合价降低值=转移电子数=5e﹣ , 用双线桥表示该反应电子转移的方向和数目为: 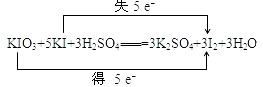 ,
,
故答案为: 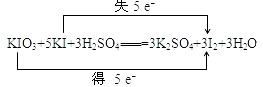 ;
;
(3.)在上述反应中,转移5mol电子生成碘单质的量是3mol,所以如果反应中转移0.2mol电子,则生成I2的物质的量为0.2mol× ![]() =0.12moL,故答案为:0.12mol;
=0.12moL,故答案为:0.12mol;
(4.)食盐中加碘加的是碘酸钾,可以将碘酸根离子转化为碘单质,需要一种还原剂(碘化钾)来实现,再根据碘单质遇到淀粉显示蓝色来检验,在酸性环境下,碘酸根离子和碘离子之间反应生成碘单质,所以选择的试剂有:KI溶液、淀粉溶液、稀硫酸,
故答案为:②③④.
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由﹣1价升高为0,该反应中转移5e﹣ , 结合淀粉遇碘单质变蓝来解答.


科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是( )
A. 常温下所有的金属都是固态
B. 金属具有导电、导热和延展性
C. 金属都具有较高的硬度和密度
D. 金属都具有较高的熔点和沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用3.0 mol·L-1的硫酸溶液与锌粒反应制取氢气。下列措施中可能加大反应速率的是
A.适当降低温度B.将锌粒改为锌粉
C.将所用硫酸换成98%的浓硫酸D.加入少量醋酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,下图所示为海水综合利用部分流程,有关说法正确的是( )

A. 上述工艺流程中涉及到化合、分解、复分解和置换反应
B. ①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2
C. ③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2
D. ④中反应的离子方程式为SO2+Br2+2H2O===4H++SO42-+2Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.5mol的Y元素的离子得到6.02×1023个电子后被还原成中性Y原子,另外已知0.4gY的氧化物恰好与100mL 0.2molL﹣1 的盐酸完全反应,且Y原子核内质子数和中子数相等.若Y是短周期中某种金属元素.回答下列问题:
(1)Y的名称为 , 它在周期表的位置为;
(2)Y的氧化物与盐酸反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,22.4 L庚烷的分子数约为NA
B. 1 L 0.1 mol·L-l的Na2S溶液中S2-和HS-的总数为0.1NA
C. 4.0 g H![]() O与D2O的混合物中所含中子数为2NA
O与D2O的混合物中所含中子数为2NA
D. 50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com