
【题目】在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题: 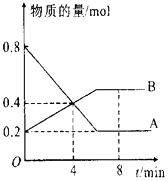
(1)请问哪条曲线代表反应物;
(2)该反应为可逆反应,请说明依据;
(3)反应开始至4min时,A的平均反应速率为 , 此时V正V逆(填“>”“<”或“=”);
(4)8min时,反应是否达平衡状态?(填“是”或“否”);
(5)反应进行至4min时,反应物的转化率为 .
【答案】
(1)A
(2)原因是反应到最后反应物的浓度不为零,且与生成物共存
(3)0.025mol/(L?min);>
(4)是
(5)50%
【解析】解:(1)反应物在反应过程中物质的量在减少,生成物在反应过程中物质的量在增加,图象分析,A物质的量在减少为反应物,B物质的量在增加为生成物,物质的量不变化说明反应达到平衡状态,所以答案是:A;(2)可逆反应是指在同一条件下,既能向生成物方向进行,同时又能向反应物方向进行的反应,任何可逆反应中,反应到最后反应物的浓度不为零,图象分析A、B最终浓度不为零,反应物和生成物共存,为可逆反应,所以答案是:原因是反应到最后反应物的浓度不为零,且与生成物共存;(3)反应开始至4min时,A物质的量变化=0.8mol﹣0.4mol=0.4mol,A的平均反应速率为V= ![]() =
= ![]() =0.025mol/(Lmin),物质的量不变化说明反应达到平衡状态,4min时AB物质的量发生变化,说明未达到平衡,可逆反应在达到平衡前,正反应速率大于逆反应速率,所以此时V正>V逆 , 所以答案是:0.025mol/(Lmin);>;(4)图象分析可知,随时间变化AB物质的量发生变化说明未达到平衡,达到平衡状态,反应继续进行,正逆反应速率相等,各组分的浓度不再变化,8min时,AB物质的量不变,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol﹣0.2mol=0.6mol;B变化物质的量=0.5mol﹣0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2AB,所以答案是:是;(5)图象分析,A物质的量在减少为反应物,反应进行至4min时,A减少0.8mol﹣0.4mol=0.4mol,转化率=
=0.025mol/(Lmin),物质的量不变化说明反应达到平衡状态,4min时AB物质的量发生变化,说明未达到平衡,可逆反应在达到平衡前,正反应速率大于逆反应速率,所以此时V正>V逆 , 所以答案是:0.025mol/(Lmin);>;(4)图象分析可知,随时间变化AB物质的量发生变化说明未达到平衡,达到平衡状态,反应继续进行,正逆反应速率相等,各组分的浓度不再变化,8min时,AB物质的量不变,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol﹣0.2mol=0.6mol;B变化物质的量=0.5mol﹣0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2AB,所以答案是:是;(5)图象分析,A物质的量在减少为反应物,反应进行至4min时,A减少0.8mol﹣0.4mol=0.4mol,转化率= ![]() ×100%=
×100%= ![]() =50%,所以答案是:50%.
=50%,所以答案是:50%.
【考点精析】掌握化学平衡的计算是解答本题的根本,需要知道反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) ![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
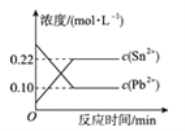
A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
C. 25 ℃时,该反应的平衡常数K=2.2
D. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 0.1mol/L氨水中,c(OH-)=c(NH4+)
B. 在常温下,10mL 0.02mol/L HCl溶液与10mL 0.02mol.LBa(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
C. 新制氯水中c(Cl-)=c(ClO-)+c(HClO)
D. 0.1mol/L KHC2O4溶液显酸性,溶液中c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列所述有关离子浓度之间的关系错误的是
A. 将0.2mol/L NaHCO3溶液与0.1mol/L KOH溶液等体积混合:3c(K+) +c(H+)=c(OH-) +c(HCO3-) +2c(CO32-)
B. 浓度均为0.1mol/L 的CH3COOH 与CH3COONa溶液等体积混合后,pH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9) mol/L
C. 将CO2通入0.1mol/L Na2CO3溶液至中性,溶液中2c (CO32-) + c (HCO3-)=0.1mol/L
D. Ka(CH3COOH)=Kb(NH3·H2O) =1.8×10-5,则常温下0.1mol/L CH3COONH4中c(CH3COO-):c(NH3·H2O)=180
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.制陶的主要原料是石英砂
B.制作陶器一般分为制泥、成型、干燥、烧成等步骤
C.制陶过程中温度越高越好,这样制得的陶器牢固
D.在氧化气氛中烧制得灰陶,在还原气氛中得红陶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,平衡常数如下:
2NO2![]() N2O4 K1 NO2
N2O4 K1 NO2![]() 1/2N2O4K2 N2O4
1/2N2O4K2 N2O4![]() 2NO2 K3
2NO2 K3
推导K1与K2,K1与K3的关系分别为:______________。
(2)衡量催化剂的性能指标有:活性、选择性、稳定性、价格等。对于给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的____(填“产率”、“比率”、转化率),催化剂的这种特性,称作它的________性。
(3)溶液的pH对Cr2O72-降解率的影响如下图所示。
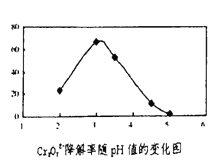
已知:Cu2O![]() Cu+CuSO4;
Cu+CuSO4;
酸性越大,Cr2O72-被还原率越大。
①由上右图可知,pH分别为2、3、4 时,Cr2O72-的降解率最好的是______,其原因是______。
②按右图加入10滴浓硫酸,溶液由橙黄色变为橙色,请结合化学用语用平衡移动原理解释其原因_____。
(4)一定条件下焦炭可以还原NO2,反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。在恒温的密闭容器下,6molNO2和足量C 发生该反应,测得平衡时NO2的物质的量与平衡总压的关系如图所示:
N2(g)+2CO2(g)。在恒温的密闭容器下,6molNO2和足量C 发生该反应,测得平衡时NO2的物质的量与平衡总压的关系如图所示:
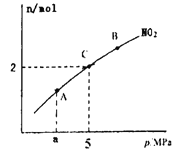
则C点NO2的转化率和C点时该反应的压强平衡常数Kp=(K,是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)分别为______、_______。
(5)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正c(CO)·c(O2),逆反应速率为v逆=K逆c(CO2)·c(O),K正、K逆为速率常数。在2500K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_______(保留小数点后一位小数)。
CO2+O。其正反应速率为v正=K正c(CO)·c(O2),逆反应速率为v逆=K逆c(CO2)·c(O),K正、K逆为速率常数。在2500K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_______(保留小数点后一位小数)。
(6)利用水煤气合成二甲醚的三步反应如下:
①2H2(g) + CO(g) ![]() CH3OH(g); ΔH1
CH3OH(g); ΔH1
②CH3OH(g) ![]() CH2OCH3(g) + H2O(g); ΔH2
CH2OCH3(g) + H2O(g); ΔH2
③CO(g) + H2O(g) ![]() CO2(g) + H2(g); ΔH3
CO2(g) + H2(g); ΔH3
总反应: 3H2(g)+3CO(g) ![]() CH2OCH3(g)+CO2(g)的ΔH=_______。
CH2OCH3(g)+CO2(g)的ΔH=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、CH4是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量分别为393.5kJ、890.3kJ.计算说明:(写出必要的文字说明和重要演算步骤,只写出最后答案的不能得分.有数值计算的题,数值结果保留到小数点后1位.)
(1)1g C完全燃烧时放出的热量.
(2)完全燃烧相同质量的C和CH4 , 哪种燃料放出热量较多?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com