
| A. | K+、SO42-、I-、NO3- | B. | Cu2+、Na+、Cl-、S2- | ||
| C. | Ca2+、K+、HCO3-、NO3- | D. | K+、Na+、CH3COO-、Br- |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,且四种离子的物质的量浓度均为0.1mol/L,遵循电荷守恒,以此来解答.
解答 解:A.四种离子的物质的量浓度均为0.1mol/L,不遵循电荷守恒,故A不选;
B.Cu2+、S2-结合生成沉淀,不能共存,故B不选;
C.四种离子的物质的量浓度均为0.1mol/L,不遵循电荷守恒,故C不选;
D.该组离子之间不反应,可大量共存,且四种离子的物质的量浓度均为0.1mol/L,遵循电荷守恒,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意电荷守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫常用于食品漂白 | |
| B. | 碳酸氢钠常用于焙制糕点 | |
| C. | 氢氧化铝可作耐高温材料 | |
| D. | 氧化钠常用作呼吸面具中的氧气来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电子转移的物质的量为1mol | |
| B. | 断裂了1mol C-H键,转移的电子数目为2NA | |
| C. | 有4gCH4参加反应,生成了5.6L的CO2 | |
| D. | 1mol CH4 (g)和2molO2(g)的能量总和大于1mol CO2 (g)和2molH2O的能量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
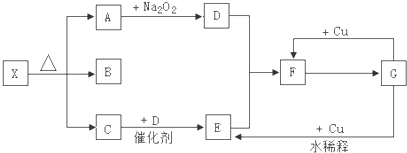
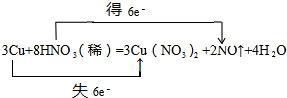 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0oC,1.01×106Pa时,11.2L氧气所含的氧原子数为NA | |
| B. | 标准状况下,80gSO3所占的体积约为22.4L | |
| C. | 31g白磷分子中,含有的共价单键数目是NA | |
| D. | 0.5 mol Na2O2中含有的阴离子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 溶液中的盐 | 固体不溶物的成分 |
| ① | FeCl2、CuCl2、FeCl3 | |
| ② | 无 | |
| ③ | FeCl2、CuCl2 | |
| ④ | Cu | |
| ⑤ | Fe、Cu |
| 组别 | ① | ② | ③ | ④ |
| 混合粉末质量/g | 40 | 40 | 40 | 40 |
| FeCl3溶液体积/mL | 150 | 300 | 330 | 350 |
| 反应后剩余固体质量/g | 23.2 | 6.4 | 2.56 | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com