
| A、油脂酸败 | B、空气液化 |
| C、白酒变酸 | D、粉尘爆炸 |
科目:高中化学 来源: 题型:
| A、氯化铝溶液与一定量的碳酸钠溶液反应:Al3++3CO32-+3H2O→Al(OH)3↓+3HCO3- | ||
B、氯化钠固体与浓硫酸混合微热:Cl-+H+
| ||
| C、氯气通入石灰乳:Cl2+2OH-→Cl-+ClO-+H2O | ||
| D、苯酚钠溶液呈碱性的原理:C6H5O-+H2O→C6H5OH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 达到平衡的次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | … |
| n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CO2 |
| CO2 |
| ① |
| 加热蒸干、灼烧 |
| ② |
| CO2 |
| ③ |
| NaOH |
| ① |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离方程 | H2CO3?H++HCO3- | HCO3-?H++CO32- | HClO?H++ClO- |
| 电离常数 | K1=4.4×lO-7 | K2=4.7×10-11 | K=3×10-8 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漏斗 | B、玻璃棒 |
| C、烧杯 | D、容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:

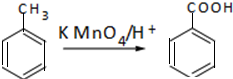

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com