
【题目】取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A , 向A 中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( )
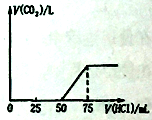
A、A溶液中溶质Na2CO3和NaHCO3物质的量比为l:l
B、A溶液中溶质NaOH和Na2CO3物质的量比为l : l
C、原NaOH 溶液物质的量浓度为0.75mol/L
D、通入CO2气体在标况下的体积为56mL
【答案】A
【解析】
试题分析:当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,由图可知,生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将Na2CO3转化为NaHCO3应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应:NaOH+HCl=NaCl+H2O,氢氧化钠溶液与二氧化碳反应后溶液中溶质为NaOH、Na2CO3。A.中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1,故A错误;B.中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1,故B正确;C.生成CO2气体最大时,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度=![]() =0.75mol/L,故C正确,D.生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2体积(标准状况下)为0.025L×0.1mol/L×22.4L/mol=0.056L,故D正确;故选A。
=0.75mol/L,故C正确,D.生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2体积(标准状况下)为0.025L×0.1mol/L×22.4L/mol=0.056L,故D正确;故选A。


科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是 ( )
A.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO![]()
B.滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl—、S2—
C.与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO![]() 、SO
、SO![]()
D.漂白粉的水溶液可能大量存在Fe2+、Cl—、Ca2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列用选、性质或变化对应正确的是
A.利用粮食酿酒的化学过程包含:淀粉一→葡萄糖一→己醇
B.在月饼包装袋中放人生石灰:防止食物氧化变质
C.焰火的绚丽:说明只有金属单质能发生焰色反应
D.氢氧化铝用于清疗胃酸过多:氢氧化锯碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.

已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.
【制备KClO及K2FeO4】
(1)装置C中三颈瓶置于冰水浴中的目的是 .
(2)C中得到足量KClO后将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 .再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,
② ,
③ ,
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由_____________ .
⑤在真空干燥箱中干燥.
【测定产品纯度】
(4)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,发生的反应为:Cr(OH)4﹣+FeO42﹣═Fe(OH)3↓+CrO42﹣+OH﹣;过滤后再加稀硫酸调节溶液呈强酸性,此时反应的离子方程式为: .
(5)将(4)反应后的溶液配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL.滴定时发生的离子反应为: .计算该K2FeO4样品的纯度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用回收的镁铝合金制取氢气。现有10.8g镁铝合金,下列说法正确的是( )
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6molH2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45molH2
C.常温下与足量2mol/LH2SO4反应,放出H2的量在0.45mol~0.6mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45mol~0.6mol之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态的是
2C(g)达到平衡状态的是
①C的生成速率与C的分解速率相等;②单位时间内生成amolA,同时生成3amolB;③气体密度不再变化;④混合气体的总压强不再变化;⑤A、B、C的物质的量之比为l:3:2;⑥混合气体的平均相对分子质量不变。
A.②④⑤⑥ B.①③④⑥ C.①②④⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经侧定ClO-和ClO3-的浓度之比为l : 3 ,则Cl2与NaoH 溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比( )
A.21:5 B.11:3 C.3:1 D.4:l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,可以发生如图转化,下列说法不正确的是( )
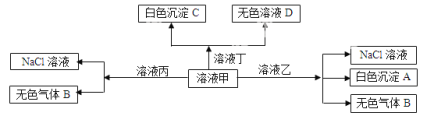
A.在甲中滴加丁可能发生反应:HCO3-+ Ba2++OH—= BaCO3↓+ H2O
B.溶液丙中还可以大量共存的离子有:I-、NO3-、SO42-
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com