
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( ) 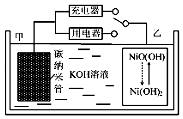
A.放电时,甲电极反应为:NiO(OH)+H2O+e═Ni(OH)2+OH
B.放电时,甲电极为正极,OH移向乙电极
C.电池总反应为H2+2NiO(OH) ![]() 2Ni(OH)2
2Ni(OH)2
D.充电时,电池的碳电极与直流电源的正极相连
【答案】C
【解析】解:A.放电时,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e﹣═Ni(OH)2+OH﹣,故A错误;
B.放电时,该电池为原电池,电解质溶液中阴离子向负极移动,所以OH﹣向负极甲电极移动,故B错误;
C.放电时,正极电极反应式为2NiO(OH)+2H2O+2e﹣═2Ni(OH)2+2OH﹣,负极电极反应式为:H2+2OH﹣﹣2e﹣═2H2O,则两式相加得总反应:H2+2NiO(OH) ![]() 2Ni(OH)2,故C正确;
2Ni(OH)2,故C正确;
D.放电时,氢气在碳电极发生氧化反应,碳电极作负极,充电时,碳电极发生还原反应作阴极,应与电源的负极相连,故D错误;
故选C.
开关连接用电器时,应为原电池原理,甲电极为负极,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH﹣﹣2e﹣═2H2O,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e﹣═Ni(OH)2+OH﹣;开关连接充电器时,为电解池,充电与放电过程相反,据此解答.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K= ![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)体积分数增加
D.增大X(g)浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氧化还原反应Fe+H2SO4=FeSO4+H2↑设计了一个原电池,如装置图,注明电极名称、反应类型,写出电极反应式。
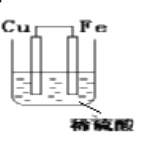
负极(_____):电极反应:___________________________ _________反应
正极(_____):电极反应:___________________________ _________反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)某密闭容器中发生反应:X(g)+Y(g)3Z(g)△H<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( ) 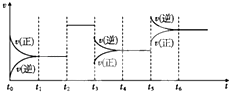
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.t4~t5时间内转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】串联电路中四个电解池分别装有0.5molL﹣1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最大的是( )
A.KNO3溶液
B.NaCl溶液
C.AgNO3溶液
D.CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1mol H2(g)完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4(g)完全燃烧生成液态水和CO2气体,放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ/mol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJ/mol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中的离子组可以大量共存的是( )
A. K+、Na+、CO32-、SO42- B. K+、Cu2+、Cl-、SO42-
C. Ba2+、H+、NO3-、SO42- D. H+、Ca2+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种短周期元素的原子序数逐渐增大。A为非金属元素,且A、E同主族,C、D为同周期的相邻元素。E原子的质子数等于C、D原子最外层电子数之和。B原子最外层电子数是内层电子数的2倍。C的氢化物分子中有3个共价键,试推断:
(1)写出B元素在周期表中的位置____________________;
(2)由A、C、D所形成的离子化合物是_______________(填化学式),所含化学键类型为_____________,它与E的最高价氧化物对应水化物的溶液加热时反应的离子方程式是___________________________。
(3) C单质的电子式为____________________。
(4) B和D相比,非金属性较强的是_________________(用元素符号表示),下列事实能证明这一结论的是________________(选填字母序号)。
a.常温下,B的单质呈固态,D的单质呈气态 b.D的氢化物的稳定性强于B的氢化物
c.B与D形成的化合物中,B呈正价 d.D的氢化物的沸点高于B的氢化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com