
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2L CO2中含有的共用电子对数为NA
B.2g由D2O与 20Ne组成的混合气体中含有的质子数为NA
C.常温下, 27g铝投入足量的浓硫酸中,生成的SO2分子数为NA
D.100mL 1mol·L1 FeCl3溶液中所含Fe3+的数目为0.1NA
科目:高中化学 来源: 题型:
【题目】硒(Se)是第四周期第ⅥA族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=akJ·mol-1
2Se(s)+2H2O(l) ΔH1=akJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=bkJ·mol-1
2H2O(l) ΔH2=bkJ·mol-1
反应H2(g)+Se(s)![]() H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是__(填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:_。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:
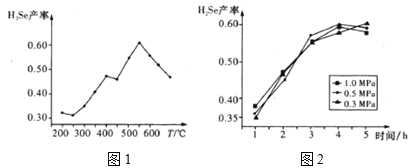
则制备H2Se的最佳温度和压强为__。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈__(填“酸性”或“碱性”),请通过计算数据说明__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳钢广泛应用在石油化工设备管道等领域,随着深层石油天然气的开采,石油和天然气中含有的CO2及水引起的腐蚀问题(俗称二氧化碳腐蚀)引起了广泛关注。深井中二氧化碳腐蚀的主要过程如下所示:
负极:![]() (主要)
(主要)
正极:![]() (主要)
(主要)
下列说法不正确的是
A.钢铁在CO2水溶液中的腐蚀总反应可表示为![]()
B.深井中二氧化碳对碳钢的腐蚀主要为化学腐蚀
C.碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量高腐蚀速率会加快
D.腐蚀过程表明含有CO2的溶液其腐蚀性比相同pH值的HCl溶液腐蚀性更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子构成的单质中既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2的是
A. 核内无中子的原子
B. 外围电子构型为3s23p4的原子
C. 核外电子排布图为![]()
![]() 的基态原子
的基态原子
D. 处于激发态时其原子的电子排布式可能为1s22s22p63s13p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛分子的结构式如图所示,下列描述正确的是( )
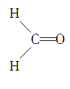
A. 甲醛分子中有4个σ键
B. 甲醛分子中的C原子为sp3杂化
C. 甲醛分子中的O原子为sp杂化
D. 甲醛分子为平面三角形,有一个π键垂直于三角形平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与原因对应关系不正确的是
A | B | C | D | |
物质 |
Na2FeO4 |
海水稻 |
金属铜 |
碳酸钠 |
事实 | 用于自来水净水消毒 | 海水稻的秸杆可以燃烧发电 | Cu作原电池的电极 | 制革工业中原料皮的脱脂 |
主要原因 | Na2FeO4有强氧化性且能在水中产生胶体 | 稻子的秸杆中蕴含生物质能 | Cu能导电且质稳定 | Na2CO3稳定性强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二次电池充放电时总反应可表示为Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
A.该电池可用H2SO4溶液作电解液
B.放电时,当有1molFe(OH)2生成时,电解质溶液中通过的电子数为2NA
C.放电时,Fe所在的电极发生还原反应
D.充电时,阳极的电极反应式为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物柴油是指由动植物油脂(脂肪酸甘油三酯)与醇(甲醇或乙醇)经酯交换反应得到的脂肪酸单烷基酯,可以替代普通柴油使用的清洁的可再生能源。某同学利用菜籽油与甲醇制备生物柴油,其原理及实验步骤:
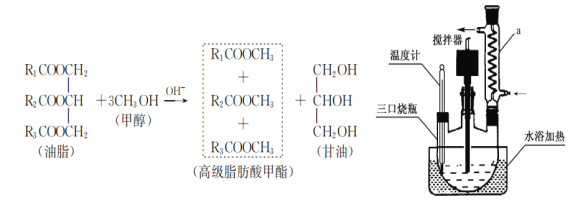
①称取4.6g CH3OH和0.2g NaOH依次放入锥形瓶中,充分震荡得NaOH溶液甲醇溶液;
②将20g 菜籽油、20g正己烷(作溶剂)、步骤1配得的NaOH甲醇溶液一次加入到三口烧瓶中;
③安装装置(如图)恒温水浴加热,使温度保持在60~65℃左右,搅拌速度400r/min,回流1.5h~2h;
④冷却、分液、水洗、回收溶剂并得到生物柴油。
回答下列问题:
(1)仪器a的名称是_________________ 。
(2)试验中取用的甲醇与油脂的物质的量之比约为6:1,甲醇过量的主要目的是________________;NaOH的用量不宜过多,其原因是____________________________。
(3)步骤4的液体分为两层,上层为生物柴油、正己烷和甲醇。下层主要为甘油、分离出下层液体的方法是_______________________________________ ;上层液体需用温水洗涤,能说明已洗涤干净的依据是____________________________________。
(4)碘值是指每100g油品所能吸收碘(I2)的质量。测定产品碘值得步骤如下:
I.准确称取m g 油品,注入碘量瓶中,向碘量瓶中加入20 mL氯仿溶解后,加入25.00mL韦氏碘液,(IBr溶液及催化剂,发生反应:![]() ),立即加塞,摇匀后,将碘量瓶放于黑暗处。
),立即加塞,摇匀后,将碘量瓶放于黑暗处。
II.30min 后立即加入20 mL 15%的碘化钾溶液和100 mL水,发生反应的化学方程式为 __________________________________________ ,不断震荡,用c mol·L-1 的Na2S2O3溶液滴定至溶液呈浅黄色时,加入1mL 淀粉指示剂,继续滴定(I2 + 2Na2S2O3=2NaI+Na2S4O6),至终点是消耗V1 mL Na2S2O3溶液。滴定终点的现象是 ______________________________________________ 。
III.另做空白对照试验,除不加油品外,其余操作同上,至终点时消耗V2 mL Na2S2O3溶液。则测得的油品的碘值为__________________ g/100g (列出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com