
【题目】使用哪组试剂可鉴别在不同试剂瓶内的1—己烯、甲苯和丙醛( )
A.KMnO4酸性溶液和溴的CCl4溶液。
B.银氨溶液和溴的CCl4溶液。
C.FeCl3溶液和银氨溶液。
D.银氨溶液和KMnO4酸性溶液。
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】取一小块钠放在坩埚里加热,下列实验现象正确的是
①金属先熔化
②在空气中燃烧,火焰呈黄色
③燃烧时火星四射
④燃烧后生成淡黄色固体
⑤燃烧后生成白色固体
A.①②③ B.①②④ C.①②⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:
(1)实验室配制氯化铝溶液时加入盐酸的目的是 .
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是(选填编号).a.Na2CO3b.NaOHc.NaAlO2d.H2SO4
(3)用滴管向试管中滴加少量AlCl3溶液时,滴管不得伸入试管中的理由是用试管夹夹持上述试管在酒精灯上加热时,不断上下移动试管的目的是 . 取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体的组成可表示为:Al2(OH)nCl(6﹣n) , 为确定n的值,取3.490g白色固体,全部溶解在0.1120mol 的HNO3(足量)中,并加水稀释成100mL,将溶液分成两等份,进行如下实验:
(4)一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g.判断加入氨水已足量的操作是 . 过滤、洗涤后至少要灼烧次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因可能是(选填编号).a.干燥Al(OH)3固体时易失水 b.Al2O3的质量比Al(OH)3大,误差小
c.沉淀Al(OH)3时不完全d.灼烧氧化铝时不分解
(5)从另一份溶液中取出20.00mL,用0.1290mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管).则滴定管的读数mL,Al2(OH)nCl(6﹣n)中n的值为 . 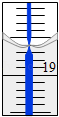
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行试验.A,B两种常见金属,它们的硫酸盐可溶于水,当K闭合时,在交换膜处SO ![]() 从右向左移动.下列说法错误的是( )
从右向左移动.下列说法错误的是( ) 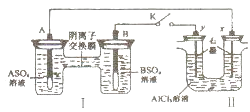
A.电解一段时间后,向Ⅱ装置通入适量的HCl气体可以恢复原来的浓度
B.反应初期,y电极周围出现白色沉淀
C.B电极质量增加
D.x电极产生气泡,且生成1mol气体的同时,有1molA参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中氧元素的数据见如图,说法正确的是( ) 
A.氧元素的质量数是16
B.氧元素的相对原子质量是16.00
C.氧原子2p亚层有一个未成对电子
D.氧原子最外层有6个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是以电解饱和食盐水为原理的重要化工生产业.
(1)电解饱和食盐水的化学方程式是
(2)电解时阳极区溶液的pH用盐酸控制在2~3,用化学平衡移动原理解释盐酸的作用;
(3)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42﹣等杂质.某次除杂操作时,往粗盐水中先加入过量的(填化学式),至沉淀不再产生后,再加入过量的(填化学式)和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42﹣ , 解释其原因[已知:Ksp(BaSO4)=1.1×10﹣10、Ksp(BaCO3)=5.1×10﹣9].
(4)食盐水中若含有NH4+ , 会在阳极产生难溶于水的NCl3 , 写出该电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A. | 向2 mL 0.1 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3受热易分解,生成了遇水显碱性的物质 |
D. | 向某溶液中加入盐酸,将生成的气体通入品红溶液中 | 品红溶液褪色 | 该溶液一定含有SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( ) 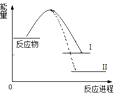
A.1molN≡N键能与3molH﹣H键能之和大于6molN﹣H键能,所以反应为放热
B.N2(g)+3H2(g)2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 6.02×1023是阿伏加德罗常数的近似值
B. 阿伏加德常数个微粒的物质的量是1mol
C. 1mol12C原子的质量为12g
D. 硫酸的摩尔质量是98克
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com