
����Ŀ���Ȼ������Ʊ����߷��ӻ����������л��ϳ����й㷺����;�����������գ�
��1��ʵ���������Ȼ�����Һʱ���������Ŀ���� ��
��2����AlCl3��Һ�м������������Һ�����յõ���ɫ������Һ������ѡ���ţ���a��Na2CO3b��NaOHc��NaAlO2d��H2SO4
��3���õι����Թ��еμ�����AlCl3��Һʱ���ιܲ��������Թ��е����������Թܼмг������Թ��ھƾ����ϼ���ʱ�����������ƶ��Թܵ�Ŀ���� �� ȡAlCl3��Һ����С�����������ˮ�պ����ɣ����ɰ�ɫ�������ɿɱ�ʾΪ��Al2��OH��nCl��6��n�� �� Ϊȷ��n��ֵ��ȡ3.490g��ɫ���壬ȫ���ܽ���0.1120mol ��HNO3���������У�����ˮϡ�ͳ�100mL������Һ�ֳ����ȷݣ���������ʵ�飺
��4��һ����������ˮ��ַ�Ӧ����ˡ�ϴ�ӡ����գ�����Al2O3������Ϊ1.020g���жϼ��백ˮ�������IJ����� �� ���ˡ�ϴ�Ӻ�����Ҫ�����Σ���д���֣����ⶨ��Ʒ����Ԫ�غ���ʱ��ѡ��ⶨ����Al��OH��3�����������DzⶨAl2O3��������ԭ���������ѡ���ţ���a������Al��OH��3����ʱ��ʧˮ b��Al2O3��������Al��OH��3�����С
c������Al��OH��3ʱ����ȫd������������ʱ���ֽ�
��5������һ����Һ��ȡ��20.00mL����0.1290mol/L�ı�NaOH��Һ�ζ����������ᣬ�ζ�ǰ�ζ��ܶ���Ϊ0.00mL���յ�ʱ�ζ���Һ�棨�ֲ�����ͼ��ʾ������Ϊ�����ߵĵζ��ܣ�����ζ��ܵĶ���mL��Al2��OH��nCl��6��n����n��ֵΪ �� 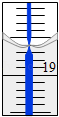
���𰸡�
��1����ֹ�Ȼ���ˮ��
��2��bd
��3����ֹ�Լ�����Ⱦ����ֹ�ֲ��������𱩷У�Al��OH��3
��4�����ã�ȡ�ϲ���Һ���μӰ�ˮ���������ɣ�2��ad
��5��18.60��5
���������⣺��1���Ȼ���ˮ�������ԣ�����������������ˮ�⣬�ʴ�Ϊ����ֹ�Ȼ���ˮ�⣻��2��a��AlCl3��Na2CO3����˫ˮ�⣺2AlCl3+3Na2CO3+3H2O=2Al��OH��3��+3CO2�����ò���������Һ����a����b��AlCl3�������������Ʒ�Ӧ����NaAlO2��Һ��AlCl3+4NaOH=3NaCl+NaAlO2+2H2O���ó�����Һ����b��ȷ��c��AlCl3��NaAlO2����˫ˮ�⣺AlCl3+3NaAlO2+6H2O=4Al��OH��3��+3NaCl���ò���������Һ����c����d��AlCl3�������Ӧ������Һ��Ϊ���壬��d��ȷ����ѡbd����3�����Թ��еμ���ҺʱӦ����ֱ�����ա���Ŀ���Ƿ�ֹ��Ⱦ�Լ������Թܼмг������Թ��ھƾ����ϼ���ʱ��Ҫ�����ƶ��Թܷ�ֹ�ֲ����У�AlCl3��Һ����ʱ����ˮ�����ɵ�HCl�ǻӷ����ᣬHCl�Ļӷ�����ˮ�ⱻ�ٽ��������յ�Al��OH��3���ʴ�Ϊ����ֹ�Լ�����Ⱦ����ֹ�ֲ��������𱩷У�Al��OH��3 �� ��4���ж��Լ��ѹ����ķ����Ǽ����μӣ�������ˮ�������ʱ��ȥ�ϲ���Һ�����μӰ�ˮ�����������ɣ������õ�Al��OH��3������������2��3�Σ����������������0.1g��˵��Al��OH��3�ֽ���ȫ��Al2O3 �� ��ѡ��ⶨ����Al��OH��3�����������DzⶨAl2O3��������ԭ���Ǹ���Al��OH��3ʱ�ֽ�ʧˮ������Al2O3��ʧˮ���ʴ�Ϊ�����ã�ȡ�ϲ���Һ���μӰ�ˮ���������ɣ�2��ad����5���ζ��ܵ�0�̶����ϣ��ʵζ��ܵĶ���Ϊ18.60mL�������ĵ��������Ƶ����Ϊ18.60mL������0.1120mol HNO3������������ԭ��3.490gAl2��OH��nCl��6��n����OH�����ĵĺͱ�0.1290mol/L�ı�NaOH��Һ���ĵģ����У�0.112mol= ![]() �����n=5���ʴ�Ϊ��18.60��5�� ��1���Ȼ���ˮ�������ԣ���2��a��AlCl3��Na2CO3����˫ˮ�⣻b��AlCl3�������������Ʒ�Ӧ����NaAlO2��Һ��c��AlCl3��NaAlO2����˫ˮ�⣻d��AlCl3�������Ӧ����3�����Թ��еμ���ҺʱӦ����ֱ�����ա������Թܼмг������Թ��ھƾ����ϼ���ʱ��Ҫ�����ƶ��Թܷ�ֹ�ֲ����У�AlCl3��Һ����ʱˮ�ⱻ�ٽ�����Al��OH��3����4���ж��Լ��ѹ����ķ����Ǽ����μӣ�����ˮ�������ʱ��ȥ�ϲ���Һ�����μӰ�ˮ�����������ɣ������õ�Al��OH��3������������2��3�Σ����������������0.1g��˵��Al��OH��3�ֽ���ȫ��Al2O3 �� ��ѡ��ⶨ����Al��OH��3�����������DzⶨAl2O3��������ԭ����Al��OH��3���ȶ��Բ���Al2O3�ã���5���ζ��ܵ�0�̶����ϣ�����0.1120mol HNO3������������ԭ��3.490gAl2��OH��nCl��6��n����OH�����ĵĺͱ�0.1290mol/L�ı�NaOH��Һ���ĵģ��ݴ˼��㣮
�����n=5���ʴ�Ϊ��18.60��5�� ��1���Ȼ���ˮ�������ԣ���2��a��AlCl3��Na2CO3����˫ˮ�⣻b��AlCl3�������������Ʒ�Ӧ����NaAlO2��Һ��c��AlCl3��NaAlO2����˫ˮ�⣻d��AlCl3�������Ӧ����3�����Թ��еμ���ҺʱӦ����ֱ�����ա������Թܼмг������Թ��ھƾ����ϼ���ʱ��Ҫ�����ƶ��Թܷ�ֹ�ֲ����У�AlCl3��Һ����ʱˮ�ⱻ�ٽ�����Al��OH��3����4���ж��Լ��ѹ����ķ����Ǽ����μӣ�����ˮ�������ʱ��ȥ�ϲ���Һ�����μӰ�ˮ�����������ɣ������õ�Al��OH��3������������2��3�Σ����������������0.1g��˵��Al��OH��3�ֽ���ȫ��Al2O3 �� ��ѡ��ⶨ����Al��OH��3�����������DzⶨAl2O3��������ԭ����Al��OH��3���ȶ��Բ���Al2O3�ã���5���ζ��ܵ�0�̶����ϣ�����0.1120mol HNO3������������ԭ��3.490gAl2��OH��nCl��6��n����OH�����ĵĺͱ�0.1290mol/L�ı�NaOH��Һ���ĵģ��ݴ˼��㣮


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������пԭ����У�������ͭΪ�������Һ��пΪ_____�����缫�Ϸ�������_____��Ӧ������������ԭ�������缫��ӦʽΪ_____��пƬ�Ϲ۲쵽������Ϊ_____��Ϊ_____�����缫�Ϸ�������_____��Ӧ������������ԭ�������缫��Ӧʽ��_____����Ƭ�Ϲ۲쵽��������_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵ�����г����Ŀ��� ��ϡ���� ������ˮ ��ѪҺ���ܹ۲쵽�����ЧӦ���ǣ� ��
A. �٢�B. �ڢ�C. �٢�D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����ͬһԭ�����͵���
A��Cl2��Fe��Cu��Ӧ�����ɸ��Ȼ��� B��NH4HCO3���塢����I2���Ⱦ��ܱ������
C��SO2��Cl2����ʹƷ����Һ��ɫ D��ClO�� Fe2+��H+�����ܴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶���ijЩ���ӵļ��鼰����һ����ȷ����(����)
A.��ͭ˿������ϴ�Ӻ�պȡNaCl��Һ���ھƾ��������գ��۲���ɫΪ��ɫ��֤����Na��
B.����NaOH��Һ�����ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ������ԭ��Һ��һ����NH4+
C.���������ữ�����ᱵ��Һ������ɫ��������һ����SO42-
D.����̼������Һ������ɫ�������ټ����ᣬ��ɫ������ʧ��һ����Ba2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ���� (����)
A. ����������Һ��ϡ���ᷴӦ:OH-+H+=H2O
B. ̼���������ϡ���ᷴӦ:CaCO3+2H+=Ca2++H2O+CO2��
C. �Ȼ�����Һ�������ˮ��Ӧ:Al3++4NH3��H2O=AlO2-+4NH4++2H2O
D. ����ˮ��Ӧ:Na+2H2O=Na++2OH-+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ĿǰΪֹ�����ѷ��ֻ�ϳ���118��Ԫ�أ�Ԫ�آ�-�������ڱ��е�λ�����±���ʾ(��Ŵ�����Ӧ��Ԫ��)��
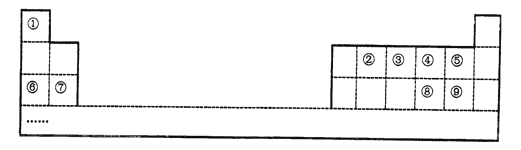
(1)�������ڱ��е�λ��_________
(2)Ԫ�آݡ��ࡢ���У�ԭ�Ӱ뾶�Ӵ�С��˳����________(��Ԫ�ط��ű�ʾ)
(3)����ߵ�����������Ӧ��ˮ����ļ���ǿ��Ϊ______��(�ѧʽ)
(4)�ٷֱ���ڢۢܢ��γɵĻ������У����ȶ������ʵĻ�ѧʽ��______.
(5)��˵����ķǽ����ԱȢ�ǿ�Ļ�ѧ����ʽΪ_______
(6)���������Ԫ�آ��γɵ�����⻯��ĵ���ʽ��___�������ӹ�ҵ�У���ˮ��Һ������ʴ��H2O2������������ò��ﲻ��Ⱦ�������仯ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ�������Լ��ɼ����ڲ�ͬ�Լ�ƿ�ڵ�1����ϩ���ױ��ͱ�ȩ�� ��
A.KMnO4������Һ�����CCl4��Һ��
B.������Һ�����CCl4��Һ��
C.FeCl3��Һ��������Һ��
D.������Һ��KMnO4������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ᡢ����������أ�����˵���д������
A.ҽ�þƾ����������Ҵ�ʹ�����ʱ�����ɱ������.
B.���������ձ��м�����Ⱦָ������ĿΪSO2��NOx��CO2
C.˫��ˮ�����������Һ����ԭ����Ư����������ˮ��ԭ����ͬ
D.��¯ˮ���к��е�CaSO4�����ñ���̼������Һ����,Ȼ���������ȥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com