
【题目】下列事实能用同一原理解释的是
A.Cl2与Fe、Cu反应均生成高价氯化物 B.NH4HCO3晶体、固体I2受热均能变成气体
C.SO2、Cl2均能使品红溶液褪色 D.ClO与 Fe2+、H+均不能大量共存
科目:高中化学 来源: 题型:
【题目】常温下时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5 | K1=4.3×10﹣7 | 3.0×10﹣8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为 .
(2)同浓度的CH3COO﹣、HCO ![]() 、CO
、CO ![]() 、ClO﹣结合H+的能力由强到弱的顺序为 .
、ClO﹣结合H+的能力由强到弱的顺序为 .
(3)同浓度的醋酸钠、次氯酸钠、碳酸钠三种溶液的pH值由小到大的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小块钠放在坩埚里加热,下列实验现象正确的是
①金属先熔化
②在空气中燃烧,火焰呈黄色
③燃烧时火星四射
④燃烧后生成淡黄色固体
⑤燃烧后生成白色固体
A.①②③ B.①②④ C.①②⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L氦气所含质子数为4NA
B. 3mol Fe在氧气中完全燃烧失去的电子数为9NA
C. 32gO2与足量的钠完全反应转移的电子数不一定为4NA
D. 1mol/L的H2SO4溶液中所含H+数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在工业上有着广泛的应用.
完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式 .
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:
Mn2++S2O82﹣+H2O→ MnO4﹣+SO42﹣+H+
配平该反应方程式,氧化产物是 .
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在(填:“阳极”或“阴极”)反应生成S2O82﹣ , 另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到 g氢气.
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);
H++SO42﹣(Ki=1.2×10﹣2);
在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是 , 第4位的离子是 . 往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中 ![]() (填:“增大”、“减小”或“不变”)
(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣,K=1.02×10﹣7
NH4++H2ONH3H2O+H+ , K=5.65×10﹣10
往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是(选填编号).
a.HSO3﹣+Ba2++OH﹣→BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣→2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣→BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣→3BaSO3↓+4H2O+2NH3H2O+SO32﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:
(1)实验室配制氯化铝溶液时加入盐酸的目的是 .
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是(选填编号).a.Na2CO3b.NaOHc.NaAlO2d.H2SO4
(3)用滴管向试管中滴加少量AlCl3溶液时,滴管不得伸入试管中的理由是用试管夹夹持上述试管在酒精灯上加热时,不断上下移动试管的目的是 . 取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体的组成可表示为:Al2(OH)nCl(6﹣n) , 为确定n的值,取3.490g白色固体,全部溶解在0.1120mol 的HNO3(足量)中,并加水稀释成100mL,将溶液分成两等份,进行如下实验:
(4)一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g.判断加入氨水已足量的操作是 . 过滤、洗涤后至少要灼烧次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因可能是(选填编号).a.干燥Al(OH)3固体时易失水 b.Al2O3的质量比Al(OH)3大,误差小
c.沉淀Al(OH)3时不完全d.灼烧氧化铝时不分解
(5)从另一份溶液中取出20.00mL,用0.1290mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管).则滴定管的读数mL,Al2(OH)nCl(6﹣n)中n的值为 . 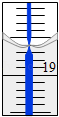
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行试验.A,B两种常见金属,它们的硫酸盐可溶于水,当K闭合时,在交换膜处SO ![]() 从右向左移动.下列说法错误的是( )
从右向左移动.下列说法错误的是( ) 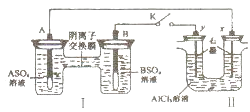
A.电解一段时间后,向Ⅱ装置通入适量的HCl气体可以恢复原来的浓度
B.反应初期,y电极周围出现白色沉淀
C.B电极质量增加
D.x电极产生气泡,且生成1mol气体的同时,有1molA参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( ) 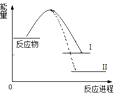
A.1molN≡N键能与3molH﹣H键能之和大于6molN﹣H键能,所以反应为放热
B.N2(g)+3H2(g)2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com