
(1)已知:2SO2(g) + O2 == 2SO3(g) △H=-196.6 kJ·mol-1,2NO(g) + O2 == 2NO2(g) △H=-113.0 kJ·mol-1。则反应NO2(g) + SO2(g) == SO3(g) + NO(g) 的△H = __________。
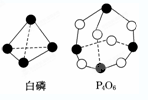
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol 化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198 kJ·mol-1、E(P-O)=360 kJ·mol-1、E(O=O)=498 kJ·mol-1,则反应P4(白磷)燃烧生成P4O6的热化学方程式为 。
科目:高中化学 来源: 题型:
等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1:2: 3,则三种硫酸盐的物质的量浓度之比为 ( )
A 1:2:3 B 1:3:3 C 1:6:9 D 1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排放的酸性废水中含有较多的Cu2+,对农作物和人畜都有害,欲采用化学法除去有害成分,最好是加入下列物质中的( )
|
| A. | 食盐、硫酸 | B. | 胆矾、石灰水 | C. | 铁粉、生石灰 | D. | 苏打、盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.相同温度下,1 mol·L-1氢氰酸溶液比1 mol·L-1盐酸溶液的pH大
B.HCN易挥发
C.10 mL1 mol·L-1 HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
D.HCN溶液的导电性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能在常温指定环境中大量共存的是
A.在c(H+)=10-10 mol·L-1的溶液中:Al3+ 、NH4+ 、Cl- 、NO3-
B.pH值为1的溶液:Fe2+、Na+ 、SO42-、NO3-
C.水电离出来的c(H+)=10-12 mol·L-1的溶液:K+、HCO3-、Cl-、ClO-
D.pH值为13的溶液:K+ 、CO32-、Na+、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类的正确组合是( )
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 氨水 | 醋酸 | 石灰石 | 二氧化碳 |
| D | 苛性钾 | 碳酸 | 胆矾 | 三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在氧化还原反应中,氧化剂经化学变化变成还原剂
B.在氧化还原反应中,氧化剂被氧化,还原剂被还原
C.在化学反应中,能把其他物质氧化的物质是氧化剂
D.在氧化还原反应中,还原剂生成的氧化产物一定只具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的化学方程
式是:4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH 工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法中错误的是( )
A.高铁酸钾处理水时,高铁酸钾发生还原反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) 
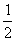 N2(g)+CO2(g)
N2(g)+CO2(g)
ΔH= -373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是 ( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com