
【题目】生活中处处可见金属和它们的化合物。
(1)金属钠与水反应后,向其中滴入石蕊试剂,溶液将呈_____色;
(2)已知一种生活中常见的金属,它既可以与盐酸反应也可以与氢氧化钠溶液反应,写出冶炼该金属的化学反应方程式:___________________________________;
(3)将铝棒与铜棒用导线连接,一起放入浓硝酸中,一段时间后,形成了较稳定的电流,则铝为该电池的_____(填电极名称);
(4)铁可以形成多种氧化物,其中常用作红色油漆和涂料的是_____(填化学式);
(5)鉴别三价铁离子和亚铁离子的方法有许多,其中之一就是利用加入酸性高锰酸钾溶液观察其是否褪色来进行判断,请写出该方法涉及的离子反应方程式:________________________。
【答案】蓝 2Al2O3 ![]() 4Al+3O2↑ 正极 Fe2O3 5Fe2++MnO
4Al+3O2↑ 正极 Fe2O3 5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O
+8H+=5Fe3++Mn2++4H2O
【解析】
(1)根据金属钠和水反应的性质解答;
(2)根据金属铝的性质解答;
(3)根据铝棒与铜棒与浓硝酸反应的性质回答;
(4)根据铁的化合物的性质回答;
(1)金属钠与水反应生成氢氧化钠和氢气,向其中滴入石蕊试剂,溶液将呈蓝色,故答案:蓝;
(2)铝是一种生活中常见的金属,它既可以与盐酸反应生成氯化铝和氢气,也可以与氢氧化钠溶液反应,生成偏铝酸钠和氢气,冶炼该金属的方法是电解熔融的氧化铝,生成铝和氧气,其反应的化学反应方程式:2Al2O3![]() 4Al+3O2↑;
4Al+3O2↑;
(3)将铝棒与铜棒用导线连接,一起放入浓硝酸中,铝遇浓硝酸发生钝化,铜和硝酸反应生成硝酸铜和二氧化氮和水,所以铜棒为负极,铝棒做正极,故答案:正极;
(4)铁可以形成多种氧化物,其中常用作红色油漆和涂料的是Fe2O3;故答案:Fe2O3;
(5)三价铁离子具有氧化性,与酸性高锰酸钾溶液不反应,亚铁离子具有还原性,能被酸性高锰酸钾氧化,该方反应的离子反应方程式:5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O,故答案:5Fe2++MnO
+8H+=5Fe3++Mn2++4H2O,故答案:5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中存在如下反应:A (g)+3B(g) ![]() 2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
![]()

下列判断一定错误的是
A.图Ⅰ研究的是压强对反应的影响,且乙的压强较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用催化剂的效率较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为: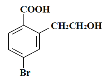 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
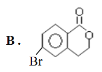
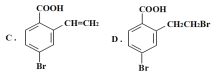
(1)1molA可以与___molNaHCO3反应,最多可以与___molNaOH反应,A与足量的NaOH溶液反应的化学方程式为:___。
(2)由A生成B的反应类型为:___。
(3)写出C在一定条件下反应,生成高分子化合物的化学方程式:___。
(4)写出由A生成D所需的试剂及反应条件:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监制环境中 NH3 的含量,其工作原理示意图如图所示,下列说法不正确的是( )
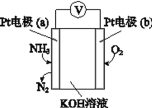
A.电池工作一段时间后pH将变大
B.反应消耗的NH3与O2的物质的量之比为4:3
C.负极的电极反应式为2NH36e6OHN26H2O
D.电流方向:电极b→导线→电极a→电解质溶液→电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有悠久的历史,在西汉就有湿法炼铜![]() ,试回答下列问题。
,试回答下列问题。
![]() 基态铜原子最外层电子所占用能级的电子云轮廓图形状为______。
基态铜原子最外层电子所占用能级的电子云轮廓图形状为______。
![]() 黄铁矿
黄铁矿![]() 主要成分
主要成分![]() 是提取硫和制造硫酸的主要矿物原料,产物氧化铁也可以用于炼铁,写出
是提取硫和制造硫酸的主要矿物原料,产物氧化铁也可以用于炼铁,写出![]() 的电子式______。
的电子式______。
![]() 金属铜广泛地应用于电气、机械制造、国防等领域。
金属铜广泛地应用于电气、机械制造、国防等领域。
![]() 受热易分解为
受热易分解为![]() 和
和![]() ,请从铜的原子结构来说明CuO受热易分解的原因:_________
,请从铜的原子结构来说明CuO受热易分解的原因:_________
![]() 向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的
向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的![]() 晶体。上述深蓝色晶体中含有的化学键除普通共价键外,还有______和______。
晶体。上述深蓝色晶体中含有的化学键除普通共价键外,还有______和______。
![]() 在硫酸铜溶液中加入过量KCN,生成配离子
在硫酸铜溶液中加入过量KCN,生成配离子![]() ,则1mol该配离子中含有的
,则1mol该配离子中含有的![]() 键的数目为_______。
键的数目为_______。
![]() 的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜
的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜![]() 该反应的化学方程式为______,氯化羰基亚铜结构示意图如图。则该化合物中与
该反应的化学方程式为______,氯化羰基亚铜结构示意图如图。则该化合物中与![]() 形成配位键的原子是______。
形成配位键的原子是______。

![]() 金铜合金的一种晶体结构为立方晶型,如图所示:
金铜合金的一种晶体结构为立方晶型,如图所示:

![]() 该合金的化学式为______;
该合金的化学式为______;
![]() 已知该合金的密度为
已知该合金的密度为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,两个金原子间最小间隙为
,两个金原子间最小间隙为![]() 。则铜原子的半径为______
。则铜原子的半径为______![]() 写出计算表达式
写出计算表达式![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题:

(1)写出①和④两种元素原子按1:1组成的常见化合物的电子式______。
(2)用电子式表示⑥和⑨形成化合物的过程:______。
(3)③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为 ______(用化学式表示)。
(4)已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式 ______。
(5)⑤、⑥、⑩的离子半径由大到小的顺序为 ______(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为 2L 的密闭容器中进行如下反应:A g + 2Bg ![]() 3Cg + nDg ,开始时 A 为 4mol,B 为 6mol,5min 末时测得 C 的物质的量为 3mol,D 的化学反应速率vD = 0.2mol L1 min1 ,请回答:
3Cg + nDg ,开始时 A 为 4mol,B 为 6mol,5min 末时测得 C 的物质的量为 3mol,D 的化学反应速率vD = 0.2mol L1 min1 ,请回答:
(1)5min 末A 的物质的量浓度为_____,
(2)前 5min 内用B 表示的化学反应速率 v(B)为_____,
(3)前 5min 内A 的转化率为_____,
(4)化学方程式中 n 的值为_____,
(5)此反应在四种不同情况下的反应速率分别为:
① v A = 5mol L1 min1 ② v B = 6mol L1 min1
③ v C = 4.5mol L1 min1 ④ v D = 8mol L1 min1
其中反应速率最快的是_____(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组比值为1∶2的是( )
A.0.1mol·L-1与0.2mol·L-1 CH3COOH溶液,c(H+)之比
B.0.1mol·L-1 Na2CO3溶液,![]()
![]() c(Na+)之比
c(Na+)之比
C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D.pH=3的H2SO4与CH3COOH溶液,![]()
![]() c(CH3COO-)之比
c(CH3COO-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是( )
A.NH3![]() NO
NO![]() HNO3
HNO3
B.浓盐酸![]() Cl2
Cl2![]() 漂白粉
漂白粉
C.Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() 无水AlCl3
无水AlCl3
D.葡萄糖![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com