
【题目】某有机物A的结构简式为: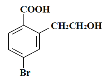 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
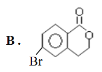
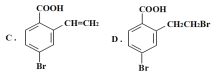
(1)1molA可以与___molNaHCO3反应,最多可以与___molNaOH反应,A与足量的NaOH溶液反应的化学方程式为:___。
(2)由A生成B的反应类型为:___。
(3)写出C在一定条件下反应,生成高分子化合物的化学方程式:___。
(4)写出由A生成D所需的试剂及反应条件:____。
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________________________。
(2)甲同学的实验目的是_____________;要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是___________________________________________________。
(4)乙同学完成该实验应选用的实验药品是________,该实验中不选用某浓度的硫酸,理由是___________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关.下列说法不正确的是![]()
A.医学上,血液透析是利用了胶体的渗析原理
B.碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂
C.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
D.铜的金属性比铝弱,可以用铜罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3C≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是( )
CH2=C(CH3)COOCH3,下列说法正确的是( )
A.CH3OH和甘油互为同系物
B.已知该反应的原子利用率为100%,则A为CO2
C.CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D.能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.等pH的醋酸溶液、盐酸溶液、硫酸溶液中:![]()
B.将10mL![]()
![]() 的
的![]() 溶液逐滴滴加到10mL
溶液逐滴滴加到10mL![]()
![]() 的盐酸中:
的盐酸中:![]()
C.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]()
D.![]()
![]() 的某一元弱酸HA溶液和
的某一元弱酸HA溶液和![]()
![]() 溶液等体积混合后的溶液:
溶液等体积混合后的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】磷化硼(BP)是一种受关注的耐磨涂层材料,可作为钛等金属表面的保护薄膜。
(1)三溴化硼和三溴化磷混合物在高温条件下与H2反应可以制得BP。
①上述反应的化学方程式为________________________;
②磷原子中存在_____种不同能量的电子,电子占据的最高能层符号为_______。
③常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该物质属于______晶体(填晶体类型)。
(2)已知磷酸是中强酸,硼酸是弱酸;pKa= -lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH >CH3COOH。据此推测,pKa:AtCH2COOH____ClCH2COOH(填“>”、“<”、“=”)
②磷酸是三元酸,写出两个与PO43-具有相同空间构型和键合形式的分子或离子_________________。
③硼酸是一元酸,它在水中表现出来的弱酸性,并不是自身电离出氢离子所致,而是水分子与B(OH)3结合,生成一个酸根离子,该阴离子的结构式为:_________(若存在配位键,请用箭头标出)。
(3)高温陶瓷材料Si3N4的成键方式如图1所示,结构中N—Si—N的键角比Si—N—Si的键角大,其原因是_____________________________________。
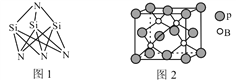
(4)磷化硼的晶体结构如图2所示。晶胞中P原子的堆积方式为________(填“简单立方”、“体心立方”或“面心立方最密”)堆积。若该晶体中最邻近的两个P原子之间的距离为a nm,则晶体密度为__________g·cm-3(只需列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处可见金属和它们的化合物。
(1)金属钠与水反应后,向其中滴入石蕊试剂,溶液将呈_____色;
(2)已知一种生活中常见的金属,它既可以与盐酸反应也可以与氢氧化钠溶液反应,写出冶炼该金属的化学反应方程式:___________________________________;
(3)将铝棒与铜棒用导线连接,一起放入浓硝酸中,一段时间后,形成了较稳定的电流,则铝为该电池的_____(填电极名称);
(4)铁可以形成多种氧化物,其中常用作红色油漆和涂料的是_____(填化学式);
(5)鉴别三价铁离子和亚铁离子的方法有许多,其中之一就是利用加入酸性高锰酸钾溶液观察其是否褪色来进行判断,请写出该方法涉及的离子反应方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com