
【题目】下列有关物质结构的表述正确的是
A.次氯酸的电子式![]()
![]() B.二氧化硅的分子式SiO2
B.二氧化硅的分子式SiO2
C.二氧化碳的比例模型:![]() D.Cl原子的结构示意图:
D.Cl原子的结构示意图:
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为: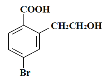 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
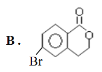
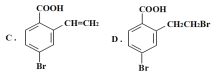
(1)1molA可以与___molNaHCO3反应,最多可以与___molNaOH反应,A与足量的NaOH溶液反应的化学方程式为:___。
(2)由A生成B的反应类型为:___。
(3)写出C在一定条件下反应,生成高分子化合物的化学方程式:___。
(4)写出由A生成D所需的试剂及反应条件:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为 2L 的密闭容器中进行如下反应:A g + 2Bg ![]() 3Cg + nDg ,开始时 A 为 4mol,B 为 6mol,5min 末时测得 C 的物质的量为 3mol,D 的化学反应速率vD = 0.2mol L1 min1 ,请回答:
3Cg + nDg ,开始时 A 为 4mol,B 为 6mol,5min 末时测得 C 的物质的量为 3mol,D 的化学反应速率vD = 0.2mol L1 min1 ,请回答:
(1)5min 末A 的物质的量浓度为_____,
(2)前 5min 内用B 表示的化学反应速率 v(B)为_____,
(3)前 5min 内A 的转化率为_____,
(4)化学方程式中 n 的值为_____,
(5)此反应在四种不同情况下的反应速率分别为:
① v A = 5mol L1 min1 ② v B = 6mol L1 min1
③ v C = 4.5mol L1 min1 ④ v D = 8mol L1 min1
其中反应速率最快的是_____(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组比值为1∶2的是( )
A.0.1mol·L-1与0.2mol·L-1 CH3COOH溶液,c(H+)之比
B.0.1mol·L-1 Na2CO3溶液,![]()
![]() c(Na+)之比
c(Na+)之比
C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D.pH=3的H2SO4与CH3COOH溶液,![]()
![]() c(CH3COO-)之比
c(CH3COO-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是( )

A.芥子醇的分子式是C11H12O4
B.芥子醇能发生水解反应
C.芥子醇分子中所有原子不可能在同一平面
D.1 mol芥子醇能与足量溴水反应消耗3 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图所示:
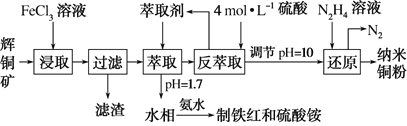
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图所示,该反应的离子方程式为______。
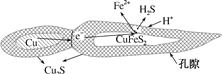
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的物质的量为______;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为______。
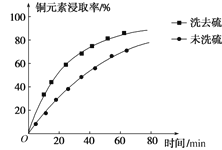
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图所示,未洗硫时铜元素浸取率较低,其原因是______。
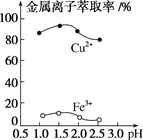
(3)“萃取”时,两种金属离子萃取率与pH的关系如图所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是______。
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为______
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、_____等操作可得到Fe2O3产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是( )
A.NH3![]() NO
NO![]() HNO3
HNO3
B.浓盐酸![]() Cl2
Cl2![]() 漂白粉
漂白粉
C.Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() 无水AlCl3
无水AlCl3
D.葡萄糖![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知,t3~t4阶段使用催化剂。下列说法中不正确的是( )
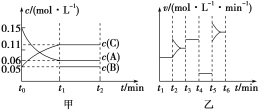
A.若t1=15 min,则用C的浓度变化表示在t0~t1时间段的平均反应速率为0.004 mol·L-1·min-1
B.t4~t5阶段改变的条件一定是减小压强
C.B的起始物质的量为0.02 mol
D.t5~t6阶段,容器内A的物质的量减少了0.03 mol,而此过程中容器与外界的热交换总量为a kJ,则该反应的热化学方程式为3A(g) B(g)+2C(g) ΔH=+100a kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com