
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图所示:
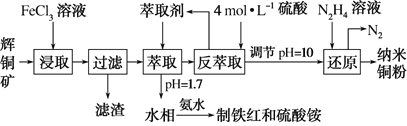
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图所示,该反应的离子方程式为______。
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的物质的量为______;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为______。
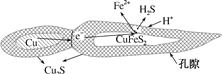
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图所示,未洗硫时铜元素浸取率较低,其原因是______。
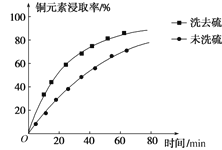
(3)“萃取”时,两种金属离子萃取率与pH的关系如图所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是______。
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为______
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、_____等操作可得到Fe2O3产品。
【答案】CuFeS2 +Cu+2H+=2CuS+Fe2++H2S↑ 2 mol 4Fe2++O2 +4H+=4Fe3++2H2O 生成的硫覆盖在Cu2S表面,阻碍浸取 Fe3+水解程度随pH的升高而增大 32:7 洗涤 煅烧(或灼烧)
【解析】
辉铜矿(主要成分为Cu2S)用FeCl3溶液作浸取剂发生反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,过滤得到氯化铜、氯化亚铁,加入萃取剂萃取,在萃取后的“水相”中加入适量氨水可制取铁红和硫酸铵;用“反萃取”得到的CuSO4溶液,调节溶液pH,在碱性条件下,Cu2+与N2H4反应生成氮气和铜,从而获得纳米铜粉,据此解答。
(1)根据图示,用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,同时生成Fe2+和H2S,反应的离子方程式为:CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑,
故答案为:CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑;
(2)①反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,反应中,FeCl3中Fe元素的化合价由+3价降低为+2价,Cu2S中Cu元素的化合价由+1价升高为+2价,硫元素的化合价由-2价升高为0价,化合价升高数=化合价降低数=转移电子数=4,每生成1mol CuCl2,反应中转移电子的物质的量为2mol,浸取时,在有氧环境下亚铁离子被氧化,生成铁离子,反应的离子方程式为:4Fe2++4H++O2=4Fe3++2H2O,
故答案为:2mol;4Fe2++4H++O2=4Fe3++2H2O;
②浸取过程中,由于生成的硫覆盖在Cu2S表面,阻碍浸取,则洗涤硫和未洗去硫相比较,未洗涤硫时铜的浸取率偏低,
故答案为:生成的硫覆盖在Cu2S表面,阻碍浸取;
(3)由于Fe3+的水解程度随着pH的升高而增大,当pH>1.7时,pH越大,金属离子萃取率越低,
故答案为:Fe3+的水解程度随着pH的升高而增大;
(4)在碱性条件下,Cu2+与N2H4反应生成氮气和铜,反应为:2Cu2++N2H4+4OH-=2Cu+N2↑+4H2O,反应中还原产物为Cu,氧化产物为N2,质量之比为(2×64):28=32:7,
故答案为:32:7;
(5)萃取后的“水相”中含有铁离子,加入氨水,反应生成氢氧化铁沉淀,煅烧可得到,方法为:在萃取后的“水相”中加入适量氨水,静置,过滤,洗涤,干燥,煅烧可得到Fe2O3产品,
故答案为:洗涤;煅烧(或灼烧)。


科目:高中化学 来源: 题型:
【题目】【物质结构与性质】磷化硼(BP)是一种受关注的耐磨涂层材料,可作为钛等金属表面的保护薄膜。
(1)三溴化硼和三溴化磷混合物在高温条件下与H2反应可以制得BP。
①上述反应的化学方程式为________________________;
②磷原子中存在_____种不同能量的电子,电子占据的最高能层符号为_______。
③常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该物质属于______晶体(填晶体类型)。
(2)已知磷酸是中强酸,硼酸是弱酸;pKa= -lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH >CH3COOH。据此推测,pKa:AtCH2COOH____ClCH2COOH(填“>”、“<”、“=”)
②磷酸是三元酸,写出两个与PO43-具有相同空间构型和键合形式的分子或离子_________________。
③硼酸是一元酸,它在水中表现出来的弱酸性,并不是自身电离出氢离子所致,而是水分子与B(OH)3结合,生成一个酸根离子,该阴离子的结构式为:_________(若存在配位键,请用箭头标出)。
(3)高温陶瓷材料Si3N4的成键方式如图1所示,结构中N—Si—N的键角比Si—N—Si的键角大,其原因是_____________________________________。
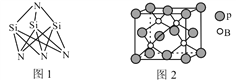
(4)磷化硼的晶体结构如图2所示。晶胞中P原子的堆积方式为________(填“简单立方”、“体心立方”或“面心立方最密”)堆积。若该晶体中最邻近的两个P原子之间的距离为a nm,则晶体密度为__________g·cm-3(只需列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____。又已知:H2O(g)=H2O(l);△H2=﹣44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是___kJ。
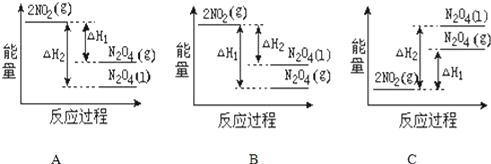
(2)已知:2NO2(g)═N2O4(g) △H1 2NO2(g)═N2O4(l) △H2,下列能量变化示意图中,正确的是(选填字母)______。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2 599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:__。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。已知某些化学键的键能数据如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能/kJmol﹣1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数分别为Kal(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10。下列说法正确的是( )
A.H2SO4在冰醋酸中的电离方程式为H2SO4+2CH3COOH=SO42-+2CH3COOH2+
B.H2SO4在冰醋酸中:![]() =c(HSO4-)+2c(SO42-)+c(CH3COO-)
=c(HSO4-)+2c(SO42-)+c(CH3COO-)
C.浓度均为0.1mol·L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸, 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质电离或盐类水解的离子方程式
(1)H2S _______________
(2)HClO _____________
(3)FeCl3 ______________
(4)Na3PO4 __________________
(5)泡沫灭火器的水解原理________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:

(1)写出反应②的化学方程式________________。
(2)B分子中无甲基,则B的结构简式为___________________。
(3)反应①和③的类型依次是______________、______________。
(4)写出反应④化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以含铁废料(含Fe、FeO、Fe2O3以及不溶于酸的杂质)制备黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:

(1)“酸溶”时,硫酸应过量的原因是____和____。
(2)“氧化”的目的是____。不能用酸性KMnO4溶液检验“氧化”后的溶液中是否含有Fe2+,原因是____。(已知氧化性:酸性KMnO4>Cl2>Fe3+)
(3)如图是温度-pH与生成的含铁化合物的关系图,图中阴影部分是黄钠铁矾稳定存在的区域。

①“沉矾”反应的离子方程式为____。
②若“沉矾”反应在80℃时进行,则需控制溶液的pH范围是____。
③“氧化”后的溶液与Na2CO3溶液发生“沉矾”反应时,适宜的混合方式是____(填字母)。
a.将“氧化”后的溶液与Na2CO3溶液同时加入到反应容器中
b.将“氧化”后的溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有“氧化”后的溶液的反应容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()

A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com