
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:

(1)写出反应②的化学方程式________________。
(2)B分子中无甲基,则B的结构简式为___________________。
(3)反应①和③的类型依次是______________、______________。
(4)写出反应④化学方程式是_______________。
【答案】nCH2=CHCl ![]()
![]() CH2=CH-CH2C1 加成反应 取代反应 CH2=CHCH3+Br2→
CH2=CH-CH2C1 加成反应 取代反应 CH2=CHCH3+Br2→![]()
【解析】
由流程可知,反应①为乙炔与氯化氢的加成反应,生成的A为CH2=CHCl,反应②为A发生加聚反应生成聚氯乙烯;根据反应④的产物的化学式可知,反应③为丙烯中甲基上H的取代反应,B分子中无甲基,所以B为CH2=CH-CH2C1,反应④为CH2=CH-CH2C1与溴发生的加成反应,据此分析解答。
(1)反应②为氯乙烯的加聚反应,反应的化学方程式为nCH2=CHCl ![]()
![]() ,故答案为:nCH2=CHCl
,故答案为:nCH2=CHCl ![]()
![]() ;
;
(2)根据上面的分析可知,B为CH2=CH-CH2C1,故答案为:CH2=CH-CH2C1;
(3)根据上面的分析可知,反应①为乙炔与氯化氢的加成反应,反应③为丙烯与氯气的取代反应,故答案为:加成反应;取代反应;
(4)反应④为CH2=CH-CH2C1与溴发生的加成反应,反应的化学方程式为CH2=CHCH3+Br2→![]() ,故答案为:CH2=CHCH3+Br2→
,故答案为:CH2=CHCH3+Br2→![]() 。
。


科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO![]() 、CO
、CO![]() 、SO
、SO![]() 、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是

A. 原溶液中一定只存在![]() 、
、![]() 、
、![]() 、Cl-四种离子
、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义.回答下列问题:
I、CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g) 的△H= ______________________________kJ/mol
II、某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g) 甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)= _________________,计算此条件下该反应的平衡常数K= _________________。
CO(g)+H2O(g) 甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)= _________________,计算此条件下该反应的平衡常数K= _________________。
III、捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
(2)用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
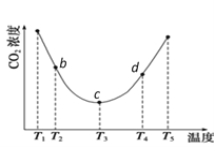
①c点的逆反应速率和d点的正反应速率的大小关系为V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为 ________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,在高温下易被空气氧化成CuO。某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
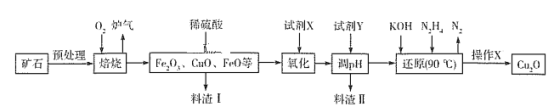
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表

(1)焙烧过程中产生的炉气是一种能造成酸雨有害气体,其化学式是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)若试剂X是H2O2溶液,其目的是为了将Fe2+离子变成Fe3+,写出相应反应的离子方程式___。当试剂X是___________时,更有利于降低生产成本。
(3)调pH时,加入的试剂Y可以为_______,pH的调控范围是________________。
(4)操作X包括________、洗涤、烘干等一系列操作,其中烘干时要隔绝空气,其目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
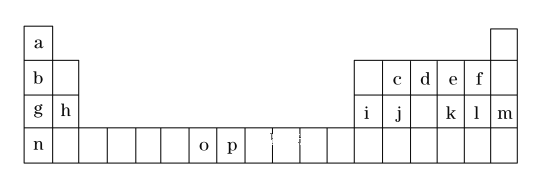
试回答下列问题:
①表中碱性最强的为_______(写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
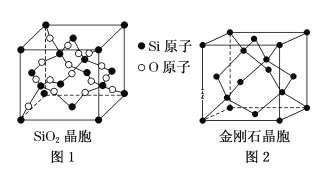
①推测SiO2晶胞中Si采用______杂化,O—Si—O的键角为___________。
②一个SiO2晶胞中,含有_______个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏伽德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFe2(PO4)3作为锂离子电池的负极材料时有良好的放电平台,通过提高材料的电导率可以有效的改善材料的性能。
(1)配平下列反应的化学方程式。___
___LiFe2(PO4)3+1Fe2O3+___CO→____CO2+___LiFePO4
(2)CO2的电子式为____,P原子的核外电子有___种不同能量的电子。
研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。
2H2(g)+2CO(g)。
(3)该反应的平衡常数K=____。在2L密闭容器中,通入CO2和CH4的混合气体,30min后,CH4的质量减少了4.8g,则v(CH4)=___。
(4)根据如图可得出n(CO2)消耗___n(CH4) 消耗(填“>”、“<”和“=”),原因是___。
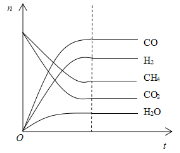
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 ①H+(aq)+OH-(aq)=H2O(l) ΔH1= -57.3 kJ·mol-1,
②2H2(g)+O2(g)=2H2O(l) ΔH2= -571.6 kJ·mol-1,下列说法正确的是
A.向含0.1 mol NaOH的溶液中加入一定体积0.1 mol·L-1乙二酸(HOOC-COOH),反应中的能量变化如图所示
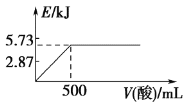
B.氢气的燃烧热为571.6 kJ·mol-1
C.若反应②中水为气态,则同样条件下的反应热:ΔH<ΔH2
D.NH3·H2O(aq)+H+(aq)=NH4+ (aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.5molFe在O2中燃烧失去的电子数为1.5NA
B.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
C.1molC2H4中所含共用电子对数为6NA
D.1L0.5mol·L-1KHCO3溶液中,阴阳离子总数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第Ⅷ族元素![]() 、
、![]() 、
、![]() 性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态![]() 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与
原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与![]() 相同的元素名称为______________。
相同的元素名称为______________。
(2)![]() 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知![]() 遇邻苯二酚(
遇邻苯二酚(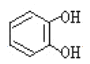 )和对苯二酚(
)和对苯二酚(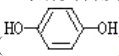 )均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
)均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
(3)有历史记载的第一个配合物是![]() (普鲁士蓝),该配合物的内界为__________。表为
(普鲁士蓝),该配合物的内界为__________。表为![]() 、
、![]() 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,![]() 比较稳定的配离子配位数是__________(填“4”或“6”)。
比较稳定的配离子配位数是__________(填“4”或“6”)。![]() 性质活泼,易被还原,但
性质活泼,易被还原,但![]() 很稳定,可能的原因是________________。
很稳定,可能的原因是________________。
离子 | 配位数 | 晶体场稳定化能(Dq) |
| 6 | -8Dq+2p |
4 | -5.34Dq+2p | |
| 6 | -12Dq+3p |
4 | -3.56Dq+3p |
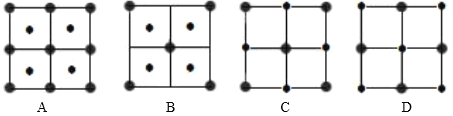
(4)![]() 晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为
晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为![]() ,晶体的密度是________
,晶体的密度是________![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com