
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.5molFe在O2中燃烧失去的电子数为1.5NA
B.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
C.1molC2H4中所含共用电子对数为6NA
D.1L0.5mol·L-1KHCO3溶液中,阴阳离子总数为1NA
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B. 当容器中混合气体密度不变时达到平衡状态
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:

(1)写出反应②的化学方程式________________。
(2)B分子中无甲基,则B的结构简式为___________________。
(3)反应①和③的类型依次是______________、______________。
(4)写出反应④化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是
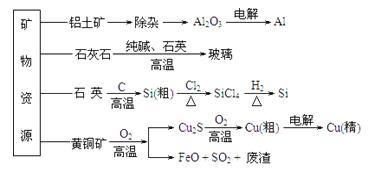
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
(1)增加水的量或温度,都可以加快镁跟水的反应速率。
(2)增加硫酸的浓度,一定可以加快铁与硫酸反应的速率
(3)对于反应CaCO3(s)![]() CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对反应3H2(g) + N2(g)![]() 2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
(5)对于反应3H2(g) + N2(g)![]() 2NH3(g),使用催化剂,正逆反应速率同等程度加快。
2NH3(g),使用催化剂,正逆反应速率同等程度加快。
A. (1) (2)B. (1) (2) (3)C. (1) (2) (3) (4)D. (5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料,实验室制备BCl3的原理为:
B2O3+3C+3Cl2![]() 2BCl3+3CO。某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3极易水解,其熔点为-107.3℃,沸点为12.5℃)请回答下列问题:
2BCl3+3CO。某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3极易水解,其熔点为-107.3℃,沸点为12.5℃)请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→___→___→____→____→F→D→I。____________
(2)BCl3接触潮湿空气时,发生反应的化学方程式为________________。
(3)能证明反应中有CO生成的现象是_______________________________________。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中。
③向其中加入V1mL C1 mol/L 的AgNO3溶液使氯离子完全沉淀。然后向其中加入少许硝基苯用力振荡。
④向锥形瓶中逐滴加入C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。
重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为____,步骤④加入的指示剂为________,(写化学式),达到终点时的现象为_____________________________________________。
(5)产品中氯元素的质量分数为_______。
(6)下列操作,可能引起测得产品中氯含量偏高是_____。
A.步骤③中未加入硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D. 滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是化肥工业和化工生产的主要原料,工业上合成氨使用的氢气主要来自合成气(CO、H2混合气体)。请回答下列问题:
(1)工业上合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH 。 已知:
2NH3(g) ΔH 。 已知:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 436 | 945.6 | 391 |
化学键的键能是形成或断裂1 mol 化学键放出或吸收的能量,单位为kJ/mol。上述反应的ΔH________________。
(2)联氨(又称肼,N2H4),试写出联氨的电子式_________;联氨又可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1
N2H4(l)+O2(g)= N2(g)+2H2O(g) ΔH2
则N2(g)+2O2(g)=N2O4 (l) ΔH3=_________
(3)以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,其装置如图所示。a电极反应式为________。若该燃料电池消耗标准状况下6.72 L空气(假设空气中O2体积分数为20%),则理论上消耗NH3的质量为_______g。

(4)甲醇燃料电池在生活应用也很广泛,在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。写出该电池的负极反应式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com