
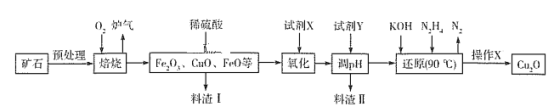
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,在高温下易被空气氧化成CuO。某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表

(1)焙烧过程中产生的炉气是一种能造成酸雨有害气体,其化学式是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)若试剂X是H2O2溶液,其目的是为了将Fe2+离子变成Fe3+,写出相应反应的离子方程式___。当试剂X是___________时,更有利于降低生产成本。
(3)调pH时,加入的试剂Y可以为_______,pH的调控范围是________________。
(4)操作X包括________、洗涤、烘干等一系列操作,其中烘干时要隔绝空气,其目的是_____。
【答案】SO2 2∶1 2Fe2++2H++H2O2=2Fe3++2H2O 空气或氧气 CuO或Cu(OH) 2 3.7≤pH<4.8 过滤 防止Cu2O被空气中氧气氧化
【解析】
根据流程图,硫化铜矿石(含CuFeS2、Cu2S等)预处理后与氧气焙烧,发生的反应有2CuFeS2+4O2 ![]() Cu2S+3SO2+2FeO、Cu2S+2O2
Cu2S+3SO2+2FeO、Cu2S+2O2 ![]() 2CuO+SO2,部分FeO被氧化为Fe2O3,得到相应的金属氧化物和二氧化硫气体,加入稀硫酸溶解金属氧化物,得到含有Cu2+、Fe2+、Fe3+的酸性溶液,加入试剂X将Fe2+氧化为Fe3+,加入试剂Y调节pH3.7~4.8沉淀Fe3+,过滤,将滤液用KOH、N2H4还原,反应为:4CuSO4+N2H4+8KOH
2CuO+SO2,部分FeO被氧化为Fe2O3,得到相应的金属氧化物和二氧化硫气体,加入稀硫酸溶解金属氧化物,得到含有Cu2+、Fe2+、Fe3+的酸性溶液,加入试剂X将Fe2+氧化为Fe3+,加入试剂Y调节pH3.7~4.8沉淀Fe3+,过滤,将滤液用KOH、N2H4还原,反应为:4CuSO4+N2H4+8KOH ![]() 2Cu2O+N2↑+4KSO4+6H2O,过滤,洗涤、烘干,制得Cu2O,据此分析解答。
2Cu2O+N2↑+4KSO4+6H2O,过滤,洗涤、烘干,制得Cu2O,据此分析解答。
(1)根据流程图,硫化铜矿石(含 CuFeS2、Cu2S等)与氧气焙烧得到金属氧化物和炉气;焙烧过程中产生的炉气是一种能造成酸雨有害气体,为SO2,Cu2S与O2反应的方程式为Cu2S+2O2 ![]() 2CuO+SO2,氧化剂为氧气,还原剂为Cu2S,氧化剂与还原剂的物质的量之比为2∶1,故答案为:SO2;2∶1;
2CuO+SO2,氧化剂为氧气,还原剂为Cu2S,氧化剂与还原剂的物质的量之比为2∶1,故答案为:SO2;2∶1;
(2)若试剂X是H2O2溶液,将Fe2+氧化为Fe3+,离子反应为:2Fe2++2H++H2O2=2Fe3++2H2O;酸性条件下,氧气也可将Fe2+氧化为Fe3+,而氧气或空气价格远低于过氧化氢,故可用氧气或空气替代,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;氧气或空气;
(3)加入试剂Y的目的是调节pH,完全沉淀Fe3+,但不沉淀Cu2+,为了不引入新杂质,可以选用CuO或Cu(OH) 2,根据表格数据可知,pH范围应为3.7≤pH<4.8;故答案为:CuO或Cu(OH) 2;3.7≤pH<4.8;
(4)根据分析N2H4制备Cu2O的化学方程式为4CuSO4+N2H4+8KOH ![]() 2Cu2O+N2↑+4KSO4+6H2O,因此操作X为过滤,洗涤、烘干,制得Cu2O;因为Cu2O具有较强的还原性,在加热条件下易被空气氧化,故烘干过程要隔绝空气,故答案为:过滤;防止Cu2O被空气中的氧气氧化。
2Cu2O+N2↑+4KSO4+6H2O,因此操作X为过滤,洗涤、烘干,制得Cu2O;因为Cu2O具有较强的还原性,在加热条件下易被空气氧化,故烘干过程要隔绝空气,故答案为:过滤;防止Cu2O被空气中的氧气氧化。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述转化关系如图所示。下列说法正确的是

A.q与s均为酸性氧化物B.原子半径:W<Y<X
C.非金属性:W<Y< XD.Z的含氧酸一定是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B. 当容器中混合气体密度不变时达到平衡状态
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中常伴随着能量变化。将Al条打磨后,插入6 mol/L盐酸中。
(1)Al与盐酸反应的离子方程式是________。
(2)该反应的能量变化可用下图中的________表示(填序号)。

(3)H2的产生速率随时间的变化如图所示。

t1~t2速率变化的主要原因是________。
t2~t3速率变化的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成![]() 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答

(1)写出鉴别苯酚与A这2种有机物的方法,用必要的文字说明: .
(2)写出以下物质的结构简式:B ,F .
(3)写出反应④的化学反应方程式:④ ,
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.28g CO和N2混合气体中含有的质子数为14NA
B.1 mol O2与足量的金属钠完全反应,转移的电子数一定为4NA
C.1 L 0.2 mol·L1的FeCl3溶液中含Fe3+的数量小于0.2NA
D.22.4L丙烷所含的碳氢键数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:

(1)写出反应②的化学方程式________________。
(2)B分子中无甲基,则B的结构简式为___________________。
(3)反应①和③的类型依次是______________、______________。
(4)写出反应④化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com