
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述转化关系如图所示。下列说法正确的是

A.q与s均为酸性氧化物B.原子半径:W<Y<X
C.非金属性:W<Y< XD.Z的含氧酸一定是强酸
【答案】B
【解析】
n是元素Y的单质,是绿色植物光合作用产生的无色气体,则Y为O元素,n为O2;p物质能使湿润的红色石蕊试纸变蓝,则p为NH3;氨气与氧气催化氧化生成NO和H2O,常温常压下r 为液体,则r为H2O,s为NO;q能使品红溶液褪色,由m和氧气反应生成,同时生成水,则q应为SO2,m为H2S,符合“m的摩尔质量为p的2倍”;综上所述W、X、Y、Z应分别为H、N、O、S;
A.NO不是酸性氧化物,故A错误;
B.电子层数越大,原子半径越大,电子层数相同核电荷数越小,原子半径越大,所以原子半径H<O<N,故B正确;
C.同周期元素自左至右非金属性增强,所以非金属性O>N,故C错误;
D.Z的含氧酸有多种,其中H2SO3为弱酸,故D错误;
故答案为B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
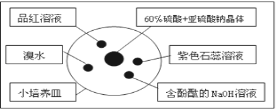
A. 紫色石蕊溶液先变红后褪色B. 品红溶液褪色
C. 溴水橙色褪去D. 含酚酞的NaOH溶液红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如图:
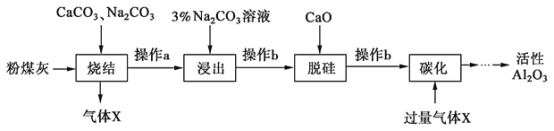
已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)写出烧结过程中铝元素转化的化学方程式________________________________。
(2)操作b的名称是_______,所用的玻璃仪器有_________________________和烧杯。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为_______________。
(4)“碳化”时生成沉淀的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图的说法不正确的是( )

A. 1mol固态碘与![]() 化合生成2molHI气体时,需要吸收5kJ的能量
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与![]() 时需要吸收12kJ的能量
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与![]() 生成HI气体的反应是吸热反应
生成HI气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO 2并验证SO 2的某些性质的装置,请回答:
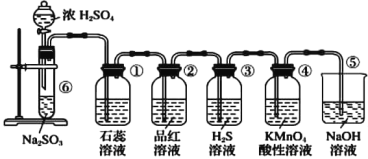
(1)在⑥中发生反应的化学方程式为_____________________。
(2)①中的实验现象为石蕊溶液__________,此实验证明SO 2具有_________的性质。
(3)②中的品红溶液________。
(4)③中发生的化学反应方程式为________________。
(5)④中的实验现象是______________________,证明SO 2有_____________性。
(6)⑤装置的作用是_________,该反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO![]() 、CO
、CO![]() 、SO
、SO![]() 、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是

A. 原溶液中一定只存在![]() 、
、![]() 、
、![]() 、Cl-四种离子
、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
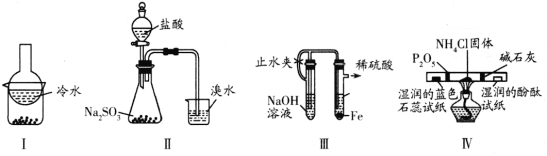
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,在高温下易被空气氧化成CuO。某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
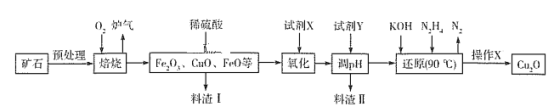
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表

(1)焙烧过程中产生的炉气是一种能造成酸雨有害气体,其化学式是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)若试剂X是H2O2溶液,其目的是为了将Fe2+离子变成Fe3+,写出相应反应的离子方程式___。当试剂X是___________时,更有利于降低生产成本。
(3)调pH时,加入的试剂Y可以为_______,pH的调控范围是________________。
(4)操作X包括________、洗涤、烘干等一系列操作,其中烘干时要隔绝空气,其目的是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com