
【题目】下图是实验室制取SO 2并验证SO 2的某些性质的装置,请回答:
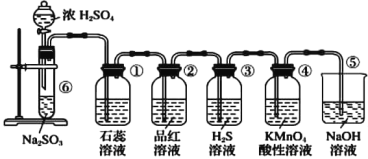
(1)在⑥中发生反应的化学方程式为_____________________。
(2)①中的实验现象为石蕊溶液__________,此实验证明SO 2具有_________的性质。
(3)②中的品红溶液________。
(4)③中发生的化学反应方程式为________________。
(5)④中的实验现象是______________________,证明SO 2有_____________性。
(6)⑤装置的作用是_________,该反应的离子方程式为________________。
【答案】Na2SO3+H2SO4(浓)= Na2SO4+ SO2↑+ H2O 变红 酸性 褪色 SO2+2H2S=3S↓+2H2O 酸性高锰酸钾褪色 还原性 吸收二氧化硫,防止二氧化硫污染空气 SO2+ 2OH-= SO32-+ H2O
【解析】
装置⑥中浓硫酸与亚硫酸钠反应生成二氧化硫,装置①中石蕊溶液变红可以验证二氧化硫溶于水显酸性;装置②中品红褪色可以验证二氧化硫的漂白性;装置③中产生淡黄色沉淀可以验证二氧化硫的氧化性;装置④中酸性高锰酸钾溶液褪色可以验证二氧化硫的还原性;装置⑤中NaOH溶液可以吸收未反应的二氧化硫。
(1)浓硫酸和亚硫酸钠可以反应生成二氧化硫,方程式为Na2SO3+H2SO4(浓)= Na2SO4+ SO2↑+ H2O;
(2)二氧化硫溶于水生成亚硫酸使溶液显酸性,所以石蕊溶液会变红,证明SO2具有酸性;
(3)二氧化硫可以漂白品红使品红溶液褪色;
(4)二氧化硫可以和硫化氢反应生成硫单质,方程式为SO2+2H2S=3S↓+2H2O;
(4)二氧化硫具有还原性可以使酸性高锰酸钾溶液褪色;
(5)二氧化硫有毒不能直接排放到空气中,可以用NaOH溶液吸收二氧化硫,防止二氧化硫污染空气,离子方程式为SO2+ 2OH-= SO32-+ H2O。


科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图:
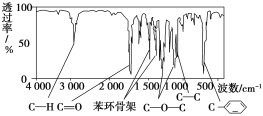
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的分子式为________。
(2)A的结构简式为_______________________________________________(写一种即可)。
(3)A的芳香化合物类同分异构体有多种,其中分子中不含甲基的芳香酸为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A. H2(g)+Br2(g)![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B. 2NO2(g)![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C. CaCO3(s)![]() CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D. N2(g)+3H2(g)![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是
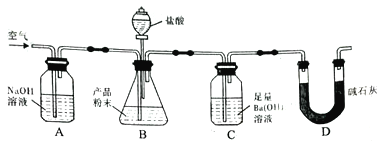
A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述转化关系如图所示。下列说法正确的是

A.q与s均为酸性氧化物B.原子半径:W<Y<X
C.非金属性:W<Y< XD.Z的含氧酸一定是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药,已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法,乙醚浸取法的主要工艺为(如图):
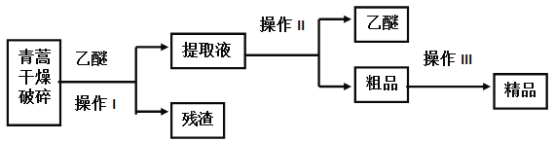
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是 _______________________________。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃________ ,操作Ⅱ的名称是__________。
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成,如图所示的是用燃烧法确定青蒿素分子式的装置:

①按上述所给的测量信息,装置的连接顺序应是_____________。(装置可重复使用)
②青蒿素样品的质量为28.2g,用合理改进后的装置进行试验,称得A管增重66g,B管增重19.8g,则测得青蒿素的最简式是_________________。
③要确定该有机物的分子式,还必须知道的数据是__________________________。
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与 ________(填字母)具有相同的性质
A.乙醇 B.乙酸 C.葡萄糖 D.乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。现进行如下图所示实验。下列有关说法正确的是

A. 步骤Ⅰ中减少的3 g固体一定是混合物
B. 步骤Ⅱ中质量减少的固体物质一定是Fe2O3
C. 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol
D. 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa的条件下,

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
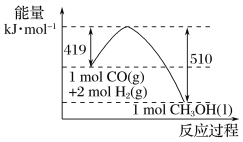
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”)________kJ能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.28g CO和N2混合气体中含有的质子数为14NA
B.1 mol O2与足量的金属钠完全反应,转移的电子数一定为4NA
C.1 L 0.2 mol·L1的FeCl3溶液中含Fe3+的数量小于0.2NA
D.22.4L丙烷所含的碳氢键数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com