
【题目】NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.28g CO和N2混合气体中含有的质子数为14NA
B.1 mol O2与足量的金属钠完全反应,转移的电子数一定为4NA
C.1 L 0.2 mol·L1的FeCl3溶液中含Fe3+的数量小于0.2NA
D.22.4L丙烷所含的碳氢键数为6NA
【答案】AC
【解析】
A.NO和N2的摩尔质量都是28g/mol,28g CO和N2混合气体的物质的量为![]() =1mol,1molCO含有质子的物质的量为(6+8)mol=14mol,1molN2中含有质子的物质的量为:2×7mol=14mol,因此1molN2和CO的混合气体中含有质子14mol,质子数为14NA,故A正确;
=1mol,1molCO含有质子的物质的量为(6+8)mol=14mol,1molN2中含有质子的物质的量为:2×7mol=14mol,因此1molN2和CO的混合气体中含有质子14mol,质子数为14NA,故A正确;
B.1 mol O2与钠反应生成氧化钠转移4NA电子,与钠反应生成过氧化钠转移2NA电子,故B错误;
C.1L 0.2 molL-1的FeCl3溶液中含有0.2 mol氯化铁,由于铁离子能够水解,数目减少,含有Fe3+数目小于0.2 NA,故C正确;
D.未注明温度和压强,无法计算22.4L丙烷的物质的量,因此无法判断所含的碳氢键数目,故D错误;
故选AC。


科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO 2并验证SO 2的某些性质的装置,请回答:
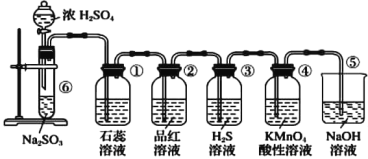
(1)在⑥中发生反应的化学方程式为_____________________。
(2)①中的实验现象为石蕊溶液__________,此实验证明SO 2具有_________的性质。
(3)②中的品红溶液________。
(4)③中发生的化学反应方程式为________________。
(5)④中的实验现象是______________________,证明SO 2有_____________性。
(6)⑤装置的作用是_________,该反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B. 25℃时,FeS的溶解度大于CuS的溶解度
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___种;基态铜原子的价电子排布式为___。
(2)N和O中第一电离能较小的元素是__;SO42-的空间构型___。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为___,H2O2难溶于CC14,其原因为___。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___。
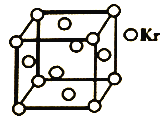
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞边长为540pm,则该晶体的密__g/cm3(只列式不计算,Kr摩尔质量为84g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,在高温下易被空气氧化成CuO。某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
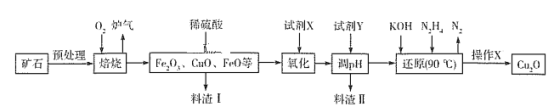
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表

(1)焙烧过程中产生的炉气是一种能造成酸雨有害气体,其化学式是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)若试剂X是H2O2溶液,其目的是为了将Fe2+离子变成Fe3+,写出相应反应的离子方程式___。当试剂X是___________时,更有利于降低生产成本。
(3)调pH时,加入的试剂Y可以为_______,pH的调控范围是________________。
(4)操作X包括________、洗涤、烘干等一系列操作,其中烘干时要隔绝空气,其目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFe2(PO4)3作为锂离子电池的负极材料时有良好的放电平台,通过提高材料的电导率可以有效的改善材料的性能。
(1)配平下列反应的化学方程式。___
___LiFe2(PO4)3+1Fe2O3+___CO→____CO2+___LiFePO4
(2)CO2的电子式为____,P原子的核外电子有___种不同能量的电子。
研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。
2H2(g)+2CO(g)。
(3)该反应的平衡常数K=____。在2L密闭容器中,通入CO2和CH4的混合气体,30min后,CH4的质量减少了4.8g,则v(CH4)=___。
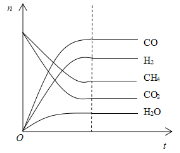
(4)根据如图可得出n(CO2)消耗___n(CH4) 消耗(填“>”、“<”和“=”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
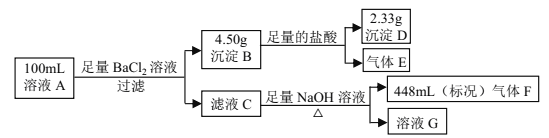
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应N2+3H2![]() 2NH3 △H<0达平衡,当单独改变下述条件后有关叙述一定错误的是
2NH3 △H<0达平衡,当单独改变下述条件后有关叙述一定错误的是
A. 加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等
B. 增加c(N2)瞬间,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数
C. 降温,v(正)和v(逆)都减少,且v(正)减少倍数小于v(逆)减少倍数
D. 加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com