
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___种;基态铜原子的价电子排布式为___。
(2)N和O中第一电离能较小的元素是__;SO42-的空间构型___。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为___,H2O2难溶于CC14,其原因为___。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___。
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞边长为540pm,则该晶体的密__g/cm3(只列式不计算,Kr摩尔质量为84g·mol-1)。
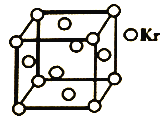
【答案】2 3d104s1 O 正四面体 sp3 H2O2为极性分子,CCl4为非极性溶剂,所以H2O2难溶于CCl4中 6 ![]()
【解析】
(1)N元素核外电子排布式为1s22s22p3,核外电子云形状有2种;Cu位于周期表中第4周期第ⅠB族,则其价电子排布式为3d104s1;
答案为2;3d104s1;
(2)N的2p为半满结构,较为稳定,第一电离能较大;对于SO42-,根据VSEPR理论,价层电子对数=4+![]() =4,则其空间构型为正四面体;
=4,则其空间构型为正四面体;
答案为O;正四面体;
(3)H2O2中O形成两根共价键,自身含有两对孤电子对,所以O为sp3杂化;H2O2分子中正负电荷中心不重合,为极性分子,CCl4为非极性分子,根据相似相容原理,极性分子难溶于非极性溶剂,所以H2O2难溶于CCl4;
答案为sp3;H2O2为极性分子,CCl4为非极性溶剂,所以H2O2难溶于CCl4中;
(4)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中配体为NO和H2O,均为单齿配体,所以配位数为6;
答案为6;
(5)1个晶胞中含有Kr原子数目为8×![]() +6×
+6×![]() =4个,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3NAcm3,则晶体密度为ρ=
=4个,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3NAcm3,则晶体密度为ρ=![]() =
=![]() g/cm3;
g/cm3;
答案为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是
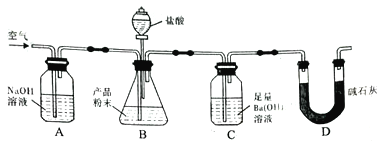
A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa的条件下,

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
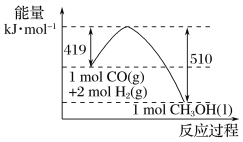
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”)________kJ能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)松油醇(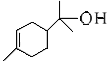 )的官能团的名称为________
)的官能团的名称为________
(2)戊烷有____种结构,请写出其中的核磁共振氢谱有1个吸收峰的结构简式__________
(3)分子式为![]() 且含两种官能团的链状有机物的结构简式为______________
且含两种官能团的链状有机物的结构简式为______________
(4)![]() 在一定条件下能生成高分子化合物的化学方程式为________________
在一定条件下能生成高分子化合物的化学方程式为________________
(5)写出甲苯生成 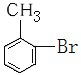 的反应方程式_____________
的反应方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中常伴随着能量变化。将Al条打磨后,插入6 mol/L盐酸中。
(1)Al与盐酸反应的离子方程式是________。
(2)该反应的能量变化可用下图中的________表示(填序号)。

(3)H2的产生速率随时间的变化如图所示。

t1~t2速率变化的主要原因是________。
t2~t3速率变化的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.28g CO和N2混合气体中含有的质子数为14NA
B.1 mol O2与足量的金属钠完全反应,转移的电子数一定为4NA
C.1 L 0.2 mol·L1的FeCl3溶液中含Fe3+的数量小于0.2NA
D.22.4L丙烷所含的碳氢键数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com