
【题目】LiFe2(PO4)3作为锂离子电池的负极材料时有良好的放电平台,通过提高材料的电导率可以有效的改善材料的性能。
(1)配平下列反应的化学方程式。___
___LiFe2(PO4)3+1Fe2O3+___CO→____CO2+___LiFePO4
(2)CO2的电子式为____,P原子的核外电子有___种不同能量的电子。
研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。
2H2(g)+2CO(g)。
(3)该反应的平衡常数K=____。在2L密闭容器中,通入CO2和CH4的混合气体,30min后,CH4的质量减少了4.8g,则v(CH4)=___。
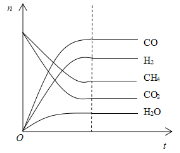
(4)根据如图可得出n(CO2)消耗___n(CH4) 消耗(填“>”、“<”和“=”),原因是___。
【答案】2LiFe2(PO4)3+1Fe2O3+3CO=3CO2+6LiFePO4 ![]() 5
5 ![]() 0.005mol/(Lmin) > 根据图中信息,有H2O生成,平衡时n(H2)<c(CO),说明一部分CO2与H2发生了反应
0.005mol/(Lmin) > 根据图中信息,有H2O生成,平衡时n(H2)<c(CO),说明一部分CO2与H2发生了反应
【解析】
(1).从化合价分析,反应中化合价变化为碳从+2价变为+4价,氧化铁的系数为1,LiFe2(PO4)3中铁的化合价为+4价,氧化铁中铁的化合价为+3价,都降低到+2价,所以氧化铁总共降低2价,LiFe2(PO4)3中铁总共降低4价,所用需要3个一氧化碳反应,再根据质量守恒定律,得方程式为: 2LiFe2(PO4)3+1Fe2O3+3CO=3CO2+6LiFePO4 ;
(2).碳的最外层有4个电子,应该形成4对共用电子,每个氧原子形成2对共用电子,所用电子式为: ![]() ;磷原子有5个能级,不同能级上的电子能量不同,所以磷有5种不同能量的电子。
;磷原子有5个能级,不同能级上的电子能量不同,所以磷有5种不同能量的电子。
(3)根据平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值分析,平衡常数K= ![]() ;甲烷的物质的量为
;甲烷的物质的量为![]() ,用甲烷表示反应速率为 v(CH4)=0.3mol÷2L÷30min=0.005mol/(Lmin) ;
,用甲烷表示反应速率为 v(CH4)=0.3mol÷2L÷30min=0.005mol/(Lmin) ;
(4). 根据图中信息,有H2O生成,平衡时n(H2)<c(CO),说明一部分CO2与H2发生了反应,所以反应中二氧化碳的消耗量大于甲烷的消耗量,。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。现进行如下图所示实验。下列有关说法正确的是

A. 步骤Ⅰ中减少的3 g固体一定是混合物
B. 步骤Ⅱ中质量减少的固体物质一定是Fe2O3
C. 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol
D. 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中常伴随着能量变化。将Al条打磨后,插入6 mol/L盐酸中。
(1)Al与盐酸反应的离子方程式是________。
(2)该反应的能量变化可用下图中的________表示(填序号)。

(3)H2的产生速率随时间的变化如图所示。

t1~t2速率变化的主要原因是________。
t2~t3速率变化的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.28g CO和N2混合气体中含有的质子数为14NA
B.1 mol O2与足量的金属钠完全反应,转移的电子数一定为4NA
C.1 L 0.2 mol·L1的FeCl3溶液中含Fe3+的数量小于0.2NA
D.22.4L丙烷所含的碳氢键数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:

(1)写出反应②的化学方程式________________。
(2)B分子中无甲基,则B的结构简式为___________________。
(3)反应①和③的类型依次是______________、______________。
(4)写出反应④化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
(1)增加水的量或温度,都可以加快镁跟水的反应速率。
(2)增加硫酸的浓度,一定可以加快铁与硫酸反应的速率
(3)对于反应CaCO3(s)![]() CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对反应3H2(g) + N2(g)![]() 2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
(5)对于反应3H2(g) + N2(g)![]() 2NH3(g),使用催化剂,正逆反应速率同等程度加快。
2NH3(g),使用催化剂,正逆反应速率同等程度加快。
A. (1) (2)B. (1) (2) (3)C. (1) (2) (3) (4)D. (5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计将废金属合金(只含铝、铁、铜)回收再利用制备胆矾、氯化铝晶体和聚合硫酸铁[Fe2(OH)n(SO4)3n/2]m的流程如下图所示,则下列有关叙述中不正确的是( )
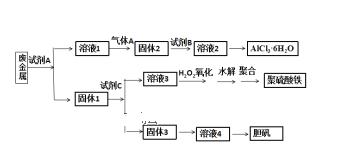
A.本实验中试剂A为氢氧化钠溶液,试剂B盐酸,试剂C为稀硫酸
B.过量气体A与溶液1的反应的离子方程式为:2AlO2- + CO2 + 3H2O = 2Al(OH) 3↓+ CO32-
C.固体3生成溶液4,可能为反应为:2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O
D.溶液3与H2O2反应的化学方程式为:2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com