
����Ŀ��180��ʱ��0.5 mol H2��1 mol CO2ͨ��2 L�ĺ����ܱ������У���ʱ��������ѹǿΪP0(��֪��ѹ=��ѹ�����ʵ�������)����Ӧ���ɼ״�����(CH3OH)��H2O����ø����ʵ����ʵ�����ʱ��IJ��ֱ仯��ͼ��ʾ���ش��������⣺
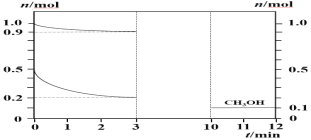
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ��___________________
(2)��0��3 min��H2��ƽ����ѧ��Ӧ����Ϊ___________________
(3)0-1���ӵ�����ΪV1��2-3���ӵ�����ΪV2,10-11���ӵ�����ΪV3����V1��V2��V3�ɴ�С��˳��Ϊ____________________________��
(4)3min��H2��ת����Ϊ______��
(5)ƽ��ʱ�������ڵ�ѹǿΪ__________��CO2�ķ�ѹΪ____________(������2λ��Ч����)
(6)��(1)�з�Ӧ��Ƴ�ԭ���(���������������Һ)����������ӦʽΪ______________��
���𰸡�CO2+3H2![]() CH3OH+H2O 0.05 mol��L-1��min-1 V1 > V2 > V3 60% 0.87P0 0.60P0 CO2+6e-+6H+ =CH3OH+H2O
CH3OH+H2O 0.05 mol��L-1��min-1 V1 > V2 > V3 60% 0.87P0 0.60P0 CO2+6e-+6H+ =CH3OH+H2O
��������
H2��CO2��Ӧ���ɼ״�����(CH3OH)��H2O����ͼ���֪��3minʱ�ﵽƽ��״̬������CO2��H2��CH3OH�ı仯����֪��Ӧ����������ϵ���ȣ��Դ�д����ѧ����ʽ��0��3 min�ڣ�����������ͬ����Ӧ��Ũ����С�����Է�Ӧ������С������0��3 min��H2Ũ�ȵı仯�������H2��ƽ����ѧ��Ӧ���ʺ�ת���ʡ��г�����ʽ���ҳ�ƽ��ʱ��������и��ɷֵ����ʵ����ķ����������CO2�ķ�ѹ������ԭ���ԭ���������������ǻ��ϼ۽��͵õ��ӵĻ�ԭ��Ӧ���ݴ˽��
(1) H2��CO2��Ӧ���ɼ״�����(CH3OH)��H2O����ͼ���֪��3minʱ�ﵽƽ��״̬��0��3 min CO2��H2��CH3OH�ı仯���ֱ�Ϊ��0.1mol��0.3mol��0.1mol����ѧ��Ӧ�б仯��֮�ȵ��ڻ�ѧ������֮�ȣ���ʽ��CO��H2��CH3OHϵ����Ϊ1:3:1����˸÷�Ӧ����ʽ�ɱ�ʾΪCO2+3H2![]() CH3OH+xH2O������ԭ���غ㣬��x=1�����Ը÷�Ӧ�Ļ�ѧ����ʽΪ��CO2+3H2
CH3OH+xH2O������ԭ���غ㣬��x=1�����Ը÷�Ӧ�Ļ�ѧ����ʽΪ��CO2+3H2![]() CH3OH+H2O��
CH3OH+H2O��
�ʴ�Ϊ��CO2+3H2![]() CH3OH+H2O��
CH3OH+H2O��
(2)��0��3 min��H2��ƽ����ѧ��Ӧ����![]() =
=![]() =
=![]() =0.05 mol��L-1��min-1��
=0.05 mol��L-1��min-1��
�ʴ�Ϊ��0.05 mol��L-1��min-1��
(3) 0��3 min�ڣ�����������ͬ����Ӧ��Ũ����С�����Է�Ӧ������С����V1��V2��V3�ɴ�С��˳��ΪV1 > V2 > V3��
�ʴ�Ϊ��V1 > V2 > V3��
(4)3min��H2��ת����Ϊ![]() ��100%=60%��
��100%=60%��
�ʴ�Ϊ��60%��
(5) CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
��ʼ����mol�� 1 0.5 0 0
�仯����mol��0.1 0.3 0.1 0.1
ƽ������mol��0.9 0.2 0.1 0.1
ƽ��ʱ������������ʵ���Ϊ��0.9mol+0.2mol+0.1mol+0.1mol=1.3mol��
������ʼ״̬��ƽ��״̬�£�ѹǿ֮�ȵ������ʵ���֮�ȣ�ƽ��ʱ�������ڵ�ѹǿΪ![]() ��P0=0.87P0��CO2�ķ�ѹΪ0.87P0��
��P0=0.87P0��CO2�ķ�ѹΪ0.87P0��![]() =0.60P0��
=0.60P0��
�ʴ�Ϊ��0.87P0 ��0.60P0��
(6) ԭ��������������ǻ��ϼ۽��͵õ��ӵķ�Ӧ�����ݷ���ʽ��֪��CO2�õ��ӣ����⣬����H2SO4���ڣ����Է�����CO2���������µĵ缫��Ӧ��CO2+6e-+6H+ =CH3OH+H2O��
�ʴ�Ϊ��CO2+6e-+6H+ =CH3OH+H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ����ͼ��ʾ��NH3������Ϊ���������ʣ�����˵��������ǣ��� ����

A. ��Һ��K+��缫b�ƶ�
B. ��Ӧ���ĵ�NH3��O2�����ʵ���֮��Ϊ4��5
C. �����ڵ缫a�Ϸ���������Ӧ
D. �����ĵ缫��ӦʽΪ��O2+4e��+2H20=4OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����淴Ӧ2NO2(g) ![]() 2NO(g)��O2(g)������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�� �ٵ�λʱ��������nmolO2��ͬʱ����2nmolNO2���ڵ�λʱ��������nmolO2��ͬʱ����2nmolNO������NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1���ܻ�������ѹǿ���ٸı䣻�ݻ���������ɫ���ٸı䣻��������ƽ����Է����������ٸı䡣
2NO(g)��O2(g)������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�� �ٵ�λʱ��������nmolO2��ͬʱ����2nmolNO2���ڵ�λʱ��������nmolO2��ͬʱ����2nmolNO������NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1���ܻ�������ѹǿ���ٸı䣻�ݻ���������ɫ���ٸı䣻��������ƽ����Է����������ٸı䡣
A. �٢ܢݢ� B. �٢ۢܢ� C. �٢ڢۢ� D. �ڢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£���ƿ��������ԭ����һ����ȵ���![]() ����
����![]()
A. ͬ������![]() ��
��![]() B. ͬ������
B. ͬ������![]() ��
��![]()
C. ͬ�����![]() ��
��![]() D. ��ͬ���ʵ�����
D. ��ͬ���ʵ�����![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ����������ºϳɼ״�����������Ҫ��Ӧ���£�
�� CO(g)��2H2(g)![]() CH3OH(g)�� ��H1 ����99kJ��mol��1
CH3OH(g)�� ��H1 ����99kJ��mol��1
�� CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H2����58 kJ��mol��1
CH3OH(g)��H2O(g) ��H2����58 kJ��mol��1
�� CO2(g)��H2(g)![]() CO(g)��H2O(g)�� ��H3
CO(g)��H2O(g)�� ��H3
��1��CO2�ĵ���ʽ��________________��
��2����H3��______kJ��mol��1���ڷ�Ӧ������ر䦤S______0(���������������)��
��3�����ݻ�Ϊ2 L���ܱ������У�����һ����CO2��H2�ϳɼ״�(�����ڷ�Ӧ)����������������ʱ���¶�T1��T2�Է�Ӧ��Ӱ��ͼ����ͼ��
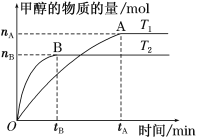
���¶�ΪT1ʱ���ӷ�Ӧ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)��_____ mol��L��1��min��1��
��ͼʾ���¶�T1______T2����д��>������<����=����
��4��T1�¶�ʱ����2 mol CO2��6 mol H2����2 L�ܱ������У���ַ�Ӧ(�����ڷ�Ӧ)�ﵽƽ�����CO2ת����Ϊ50%����ʱ�����ڵ�ѹǿ����ʼѹǿ֮��Ϊ________����Ӧ���ڸ��¶ȴﵽƽ��ʱ����ƽ�ⳣ������ֵΪ_______��
��5������Ӧ����ԭ���������ʵ�֣���д�����������¶��Ե缫����CO2����CH3OH�ĵ缫��Ӧʽ��____________________,�õ缫Ϊԭ��ص�_______����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯���ڵ��Ĺ̶�����
A. ��ҵ���ð���������ϳ������
B. �Ȼ�����ȷֽ����ɰ������Ȼ���
C. ������������Ӧ���ɵ���
D. �����������ڷŵ�����������NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ����������������������Ԫ���йص���
A.��ǿ������B.�ӵ�ʳ��C.�߽����D.�߸�ţ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.������ˮ�Ļ������Ƿǵ����
B.ij�������ˮ��Һ���Ե��磬���Ըû������ǵ����
C.�����ǵ���ʣ������������ۻ�������ˮʱ���ܵ���
D.Һ̬�Ȼ��ⲻ�ܵ��磬���Ȼ����ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У�����ԭ�Ӷ����������Ϊ8���ӽṹ���ǣ� ��
A. H2O B. SF6 C. CCl4 D. PCl5
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com