
在200mL的混合溶液中,硝酸和硫酸的物质的量的浓度均为0.2mol/L,向该混合液中加入3.84g的铜,加热使其充分反应。试计算:
(1)理论上生成的一氧化氮(标准状况下)的体积是多少升?
(2)若反应后溶液的体积不发生变化,溶液中Cu2+物质的量浓度是多少?
(6分)(1)、解:n(HNO3)=n(H2SO4)=0.2mol/L×0.2L=0.04mol,n(Cu)=3.84g÷64g/mol=0.06mol;n(H+)=n(HNO3)+2n(H2SO4)=0.12mol,n(NO3—)=n(HNO3)=0.04mol;3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O,反应物的化学计量数之比等于物质的量之比,则铜、硝酸根离子均过量,氢离子完全反应,应根据n(H+)计算n(NO);n(NO)=n(H+)/4=0.12mol/4=0.03mol;V(NO)=n?Vm=0.03mol×22.4L/mol=0.672L;(2)、根据生成物与反应物的化学计量数之比等于物质的量之比,则反应后溶液中n(Cu2+)=3n(H+)/8=0.045mol;由于反应前后溶液的体积不变,则c(Cu2+)=n(Cu2+)/V=0.045mol÷0.2L=0.225mol/L。
解析试题分析:(1)、解:n(HNO3)=n(H2SO4)=0.2mol/L×0.2L=0.04mol,n(Cu)=3.84g÷64g/mol=0.06mol;n(H+)=n(HNO3)+2n(H2SO4)=0.12mol,n(NO3—)=n(HNO3)=0.04mol;3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O,反应物的化学计量数之比等于物质的量之比,则铜、硝酸根离子均过量,氢离子完全反应,应根据n(H+)计算n(NO);n(NO)=n(H+)/4=0.12mol/4=0.03mol;V(NO)=n?Vm=0.03mol×22.4L/mol=0.672L;(2)、根据生成物与反应物的化学计量数之比等于物质的量之比,则反应后溶液中n(Cu2+)=3n(H+)/8=0.045mol;由于反应前后溶液的体积不变,则c(Cu2+)=n(Cu2+)/V=0.045mol÷0.2L=0.225mol/L。
考点:考查硝酸根离子在酸性条件下的氧化性、物质的量在化学方程式或离子方程式计算中的应用、物质的量、气体体积、气体摩尔体积、物质的量浓度、物质的质量等相关知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
硫化钠是由无水硫酸钠与炭粉在高温下反应制得。反应的化学方程式如下:
① Na2SO4+ 4C→ Na2S+ 4CO↑ ② Na2SO4+ 4CO→ Na2S+ 4CO2↑
(1)要制取Na2S 15.6 g,需原料芒硝(Na2SO4·10H2O)_____________mol。
(2)制得的Na2S固体中含少量Na2SO4、碳粉等杂质。称取该固体0.200 g,加适量水溶解后加入25.0 mL 0.100 mol/L的I2标准液,待反应完全后用0.100 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液16.0 mL(已知:滴定时 Na2S2O3转化为Na2S4O6),则该Na2S的纯度为__________。
(3)① 若在反应过程中,产生CO和CO2混合气体的体积为44.8L(标准状况),生成Na2S的物质的量(n mol)的范围是__________< n < ___________;
② 若在上述过程中生成Na2S的质量为62.4 g,则混合气体中CO和CO2的体积比是多少?
(4)硫化钠晶体(Na2S·9H2O)放置在空气中,会缓慢氧化成Na2SO3·7H2O和Na2SO4·10H2O。现称取在空气中已部分氧化的硫化钠晶体25.76 g溶于水,加入足量用盐酸酸化的BaCl2溶液,过滤得沉淀5.62 g,放出H2S气体1.12 L(标准状况),求原硫化钠晶体的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
现欲配制100 mL 1.0 mol/L的硫酸铜(CuSO4)溶液,试求:
(1)若用无水硫酸铜配制,则需要无水硫酸铜粉末的质量是多少?
(2)若用5.0 mol/L CuSO4溶液配制,则需要该溶液多少毫升?
(3)若用胆矾(CuSO4 5H2O)配制,则需要胆矾的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图。分析该图像,并回答下列问题: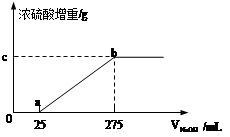
(1)写出ab段涉及的离子方程式: 。
(2)c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为 。乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
铁盐在工业、农业、医药等领域有重要的价值。
(1)将55.600g绿矾(FeSO4?7H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为 g;SO2为 mol。
(2)实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
Ⅰ.将4.400g铁屑(含Fe2O3)与25mL3mol/L H2SO4充分反应后,得到 FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。
①铁屑中Fe2O3的质量分数是 (保留两位小数)。
Ⅱ.向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。
②t℃时,(NH4)2SO4·FeSO4·6H2O的溶解度是 g/100g水(保留两位小数)。
(3)黄铁矾是难溶于水且不含结晶水的盐,它由两种阳离子和两种阴离子构成。工业上常用生成黄铁矾的方法除去溶液中的Fe2+,原理是:用氧化剂将Fe2+氧化为Fe3+,Fe3+的水解产物与溶液中某些离子一起生成黄铁矾沉淀。
实验室模拟工业过程的操作如下:
向1L 0.0500mol/L的稀硫酸中加入16.680g绿矾,完全溶解后,依次加入1.065gNaClO3(式量106.5)和1.610gNa2SO4?10H2O(式量322),充分反应后,得到9.700g黄铁矾沉淀。所得无色溶液中含有的H+为0.16 mol,SO42—为0.075 mol,Cl—为0.01mol。
计算并确定黄铁矾的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学实验小组制备硫酸亚铁铵晶体并设计实验测定其组成,他们进行了以下实验。
Ⅰ.向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到一种浅蓝绿色的硫酸亚铁铵晶体,这种晶体俗名“摩尔盐”,它比绿矾稳定得多。将摩尔盐低温烘干后,称取7.84 g加热至100 ℃失去结晶水,质量变为5.68 g。
Ⅱ.选择图所示的部分装置连接起来,检查气密性后,将上述5.68 g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。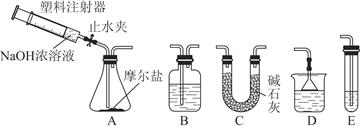
Ⅲ.向A中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。
根据上述实验回答下列问题:
(1)实验Ⅰ中,“一系列操作”依次为________、________和过滤,要检验FeSO4溶液中是否含有Fe3+常用的试剂是________。
(2)实验Ⅱ中,选择的装置是A接________接________(填代号),A装置中未使用分液漏斗的理由是____________________________________________________________
(3)向锥形瓶中加入NaOH溶液的操作方法是_________________________________________________________
吸收A中产生的气体所用试剂应是________;实验小组的同学为保证A中产生的气体被完全吸收,以准确测量其质量,他们在A中反应停止后再进行的操作是__________________________________________________________
(4)根据上述实验数据计算,此摩尔盐中,n(NH4+)∶n(Fe2+)∶n(SO42—)∶n(H2O)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差。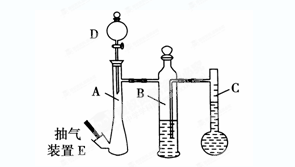
(1)若称取0.113g镁带与10.00 mL稀硫酸(足量)完全反应制取氢气,并测定1mol H2的体积(在常温常压下测定)。反应结束时C中的液面刻度为128.00 mL(A中未加硫酸时C中无液体),则得此条件下1mol H2的体积为________L(精确到0.001)。
(2)上述测出1mol H2的体积比该温度和压强下的理论值偏高的原因是(假设操作和装置都无问题)________(选填编号,下同)
A.未冷却到室温 B.反应太快
C.装置气密性不好 D.B装置漏气
(3)若利用上述装置测定CO2的气体摩尔体积。
①B中所盛放的液体应为________。
A.饱和Na2CO3溶液 B.饱和NaHCO3溶液
C.水 D.澄清石灰水
②仪器A、D中盛放的试剂应为________。
A.大理石,浓盐酸 B.纯碳酸钠,稀硫酸
C.纯碳酸钙,稀硫酸 D.纯碳酸钠,稀盐酸
(4)用以上装置测出的气体摩尔体积均比理论值大,你认为减小实验误差可行的措施是_______。
A.把A装置浸入盛水(常温)的水槽中
B.减小酸的浓度
C.把A装置浸入盛热水的水槽中
D.增大酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、烧杯胶头滴管,若要完成实验,还需要两种玻璃仪器为 、 。
⑵该实验的实验步骤为:
①计算,②称量 gNaCl, ③溶解,④移液,⑤洗涤,⑥定容,⑦ 摇匀。
⑶试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度 ;
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度 ;
③容量瓶不干燥,含有少量蒸馏水。所配溶液的浓度 ;
④若定容时仰视刻度线。所配溶液的浓度 ;
⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
物质分类的依据通常是根据它的组成和性质,下列物质分类中,只考虑组成的是
| A.硫酸钠是钠盐、硫酸盐、正盐 |
| B.二氧化硫是氧化物、酸酐、有漂白性物质 |
| C.氢氧化钠是一元碱、易溶性碱、强碱 |
| D.碳酸氢钠是钠盐、酸式盐、易分解的盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com