
| A. | 2.8mol | B. | 1.6mol | C. | 3.2mol | D. | 3.6mol |
分析 利用速率之比等于化学计量数之比计算v(B),再根据△c(B)=v(B)•△t计算B的浓度变化量,B的起始浓度-B的浓度变化量=10s后容器中B的物质的量浓度,n=VC计算溶质B物质的量.
解答 解:A的平均反应速率为0.12mol•L-1•s-1,则v(B)=$\frac{1}{3}$×0.12mol•L-1•s-1=0.04mol•L-1•s-1,
故10s后容器中B的物质的量浓度=$\frac{4mol}{2L}$-0.04mol•L-1•s-1×10s=1.6 mol/L,
B物质的量=1.6 mol/L×2L=3.2mol,
故选C.
点评 本题考查化学反应速率的有关计算,比较基础,注意公式的理解与灵活运用,题目较简单.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用油脂在碱性条件下水解可制取肥皂 | |
| B. | 煤的干馏是化学变化,煤的气化与液化是物理变化 | |
| C. | 纤维素属于天然高分子化合物,水解后可生成葡萄糖 | |
| D. | 石油裂解是深度裂化,其主要目的是为了得到乙烯、丙烯等基本化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH3•H2O ③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② | |
| B. | 常温时,pH=2的CH3COOH溶液和pH=12的氨水等体积混合;pH=2的HCl溶液和pH=12的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定相等 | |
| C. | 常温下0.2mol/L HB溶液和0.1mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.lmol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3是极性分子,其空间构型为平面正三角形 | |
| B. | CCl4是非极性分子,其中的C-Cl键为极性共价键 | |
| C. | CO2 是非极性分子,据相似相溶原理,它易溶于水中 | |
| D. | BF3是极性分子,其中心原子的杂化轨道类型为sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
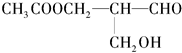 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com