
| 反应时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(PCl5)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11mol•L-1,则正反应的△H<0 | |
| C. | 相同温度下,若起始时向容器中充入1.0molPCl5和0.20 molCl2,在反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0molPCl5和1.0 molCl2,在反应达到平衡时PCl5的转化率为80% |
分析 A、由表中数据可知50s内,△n(PCl3)=0.16mol=△n(PCl5)=,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(PCl5);
B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol,根据平衡时n(PCl3),判断平衡移动方向,升高温度平衡向吸热反应方向移动;
C、先求平衡常数K,再求浓度商(Qc),K>Qc,说明平衡向正反应方向移动,K<Qc,说明平衡向逆反应方向移动,K=Qc,说明平衡不移动,据此判断平衡移动;
D、等效为起始加入1.0molPCl5,与原平衡相比,完全等效,据此判断.
解答 解:A、由表中数据可知50s内,△n(PCl3)=0.16mol=△n(PCl5),则v(PCl5)=$\frac{\frac{0.16mol}{2L}}{50s}$=0.0016mol/(L•s),故A错误;
B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×2L=0.22mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,故B错误;
C、对于可逆反应:PCl5(g)?PCl3(g)+Cl2(g),
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
所以平衡常数k=$\frac{0.1×0.1}{0.4}$=0.025,
起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=$\frac{0.1×0.1}{0.5}$=0.02,Qc<K,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;
D、等效为起始加入1.0molPCl5,与原平衡相比,完全等效,故达到平衡时,PCl3的转化率=80%,故D正确;
故选CD.
点评 本题考查反应速率、平衡常数计算、平衡移动、等效平衡等,难度中等,注意D中使用等效平衡思想分析,使问题简单化,也可以根据平衡常数计算,但比较麻烦.


科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
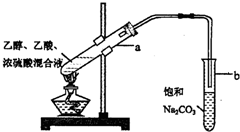
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用 | |
| B. | 用新的无害的汽油添加剂代替四乙基铅抗震剂以减少污染 | |
| C. | 火力发电用煤先进行脱硫处理,积极开发风能、生物质能发电 | |
| D. | 绿色化学要求利用化学原理从源头消除污染,期望在化学反应和化学工业过程中充分利用参与反应的原料,实现零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁制品表面水膜的酸性较强时,正极的电极反应:2H++2e-═H2↑ | |
| B. | 常温下,氯化铵溶液呈酸性:NH4++OH-?NH3•H2O | |
| C. | 向硫酸镁溶液中加入Ba(OH)2溶液,将溶液中的SO42-完全沉淀下来:SO42-+Ba2+═BaSO4↓ | |
| D. | 向氯化银浊液中加入硫化钠溶液产生黑色沉淀:2Ag++S2-═Ag2S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖浓度太浓 | B. | 加热时间不够 | C. | NaOH的量太少 | D. | CuSO4的量太少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3的摩尔质量为71g | |
| B. | 还原剂和氧化剂的物质的量之比是2:1 | |
| C. | 若生成0.2mol HNO3,则转移0.2mol电子 | |
| D. | NF3在潮湿的空气中泄漏可观察到红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S(g)+O2(g)═SO2(g)△H=a;S(s)+O2(g)═SO2(g)△H=b;则a>b | |
| B. | C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则可判定石墨比金刚石稳定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的溶液与稀盐酸完全反应,放出的热量为28.7 kJ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,则该反应任何温度下都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
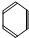 、C:CH3COOH
、C:CH3COOH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com