
| A.将人群转移到地势较低的地方,等待营救 |
| B.将槽罐车推入附近的水塘中,撒上石灰 |
| C.用高压水枪向空中喷洒大量酸性溶液 |
| D.被转移人群可戴上用NaOH处理过的口罩 |
科目:高中化学 来源:不详 题型:单选题
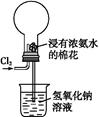
| A.烧瓶中立即出现白烟 |
| B.烧瓶中立即出现红棕色气体 |
| C.烧瓶中发生的反应表明常温下氨气有还原性 |
| D.烧瓶中还发生了化合反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
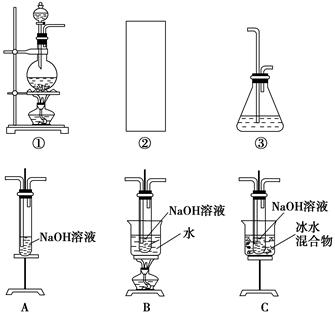
| 实验操作 | 预期现象 | 结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造光缆 |
| B.浓硝酸储罐泄漏时,可以立即喷撒消石灰或烧碱处理 |
| C.浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气 |
| D.分别充满NH3、HCl气体的烧瓶倒置于水中后液面均迅速上升,说明NH3和HCl气均易溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
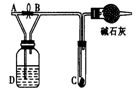
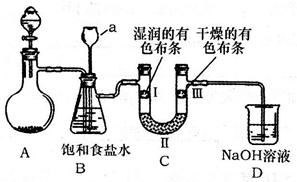
| A.D中不可能是浓硫酸 | B.D中可以是水 |
| C.通入的氯气中含有水蒸气 | D.D中可以是饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| | a | b | c |
| I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
A.实验室中浓硝酸应保存在棕色细口瓶中,并贴有如图所示标签 |
| B.用50mL量筒量取5.6mL浓硫酸 |
| C.中和滴定实验时,锥形瓶洗涤干净并用标准液润洗后,方可注入待测液 |
| D.用四氯化碳萃取碘水中的碘,分液时有机层从分液漏斗的下端放出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com