
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
| 放电 |
| 充电 |


科目:高中化学 来源: 题型:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钡沉淀率/% | 88 | 92 | 93 | 95 | 95 | 95 | 93 | 90 | 87 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省淮南市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
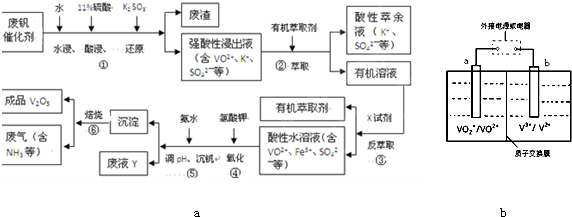
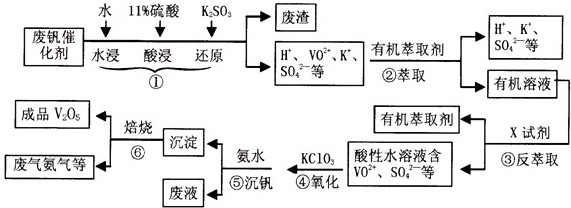
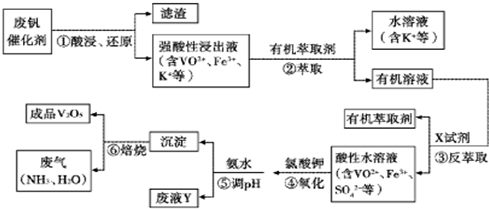
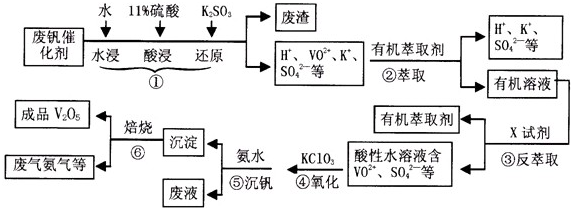
从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种生产工艺流程示意图如下,请回答下列问题:
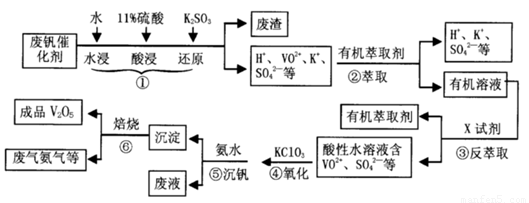
(1)步骤①中废渣的主要成分是 ,③中X试剂为 。
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是 。
(3)②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是
。
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是
。
(4)请完成④中的反应离子方程式:
□ClO3- + □VO2+ +□H+ =□VO3+ + □ +□
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
|
pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
|
钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为 。
(6)该工艺流程中,可以循环利用的物质有 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com