
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有 (填序号)。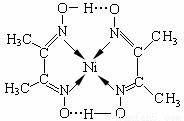
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
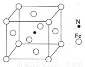
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为
(1)3d54S1 (2) sp3
(3)Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态。)
(4) ACE; N>O>C; (5) 分子晶体 (6)Fe4N
【解析】
试题分析:(1)原子处于全充满、半充满或全空时是稳定的状态。24号铬元素的基态原子的价电子排布式是3d54S1。(2)C元素Si元素组成的SiC晶体是原子晶体。其中的C原子的杂化方式为sp3。(3)根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态)。(4)在某镍配合物中含有共价键、配位键、氢键。选项为ACE。组成该配合物分子且同属第二周期元素有C、N、O。一般情况下,元素的非金属性越强,原子半径越小,元素的电负性就越大。但是对于N原子来说,由于其最外层电子处于半充满的稳定状态,所以失去电子需要的能量比O还多。因此这三种元素的电负性由大到小的顺序是N>O>C。(5) 根据四羰基镍的性质可推知该晶体所以分子晶体。(6)Fe:8×1/8+6×1/2=4;N:1。因此该磁性材料的化学式为Fe4N。
考点:考查原子结构、原子的杂化、元素电负性和第一电离能的比较、物质的结合力、晶体化学式的确定。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:选择题
在25℃、1×105Pa时,等质量的H2、Cl2、CO2、C2H2四种气体中( )
A. H2分子数最大 B. C2H2原子数最大
C. CO2密度最大 D. Cl2分子间平均距离最大
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三5月校质检理综化学试卷(解析版) 题型:选择题
[化学—物质结构与性质](13分)
Ⅰ.现今运动场馆大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED晶片,材质基本以GaAs(砷化镓)、InGaN(氮化铟镓)为主。砷化镓作为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。
已知砷化镓的晶胞结构如图所示。请回答下列问题:
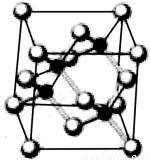
(1)下列说法正确的是 (填字母序号)。
a.砷化镓晶胞结构与NaCl相同 b.第一电离能:As>Ga
c.电负性:As>Ga d.砷化镓晶体中含有配位键
e.GaP与GaAs互为等电子体
(2)AsH3空间构型为__ __;砷化镓可由(CH3)3Ga 和AsH3在700℃时制得,(CH3)3Ga中镓原子的杂化方式为 。
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(3)Cu的价电子排布式为__________;请解释金属铜能导电的原因 。
(4)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4 晶体,晶体中
含有的化学键除普通共价键外,还有 和 。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三5月校质检理综化学试卷(解析版) 题型:选择题
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示。下列说法错误的是( )
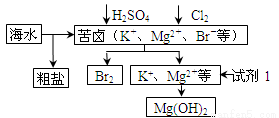
A.试剂1可以选用石灰乳
B.从苦卤中提取Br2的反应的离子方程式为:2Br - + Cl2=2Cl- + Br2
C.工业上,电解熔融MgO冶炼金属镁可减小能耗
D.可用BaCl2溶液除去粗盐中的SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:选择题
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是( )
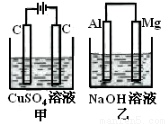
A.相同条件下产生气体的体积:V甲=V乙
B.溶液pH值变化:甲减小乙增大
C.溶液的质量变化:甲减小乙增大
D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:Mg - 2e—= Mg2+
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
(26分)按下图装置进行实验,并回答下列问题:
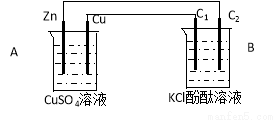
(1)判断装置的名称:A池为___________ ;B池为______________;
(2)锌极为________极,电极反应式为 ;
铜极为________极,电极反应式为 ;
石墨棒C1为______极,电极反应式为 ;
石墨棒C2附近发生的实验现象为 ;
(3)当C2极析出224mL气体(标准状态)时,锌的质量变化_________(变大、不变或变小)了________g,CuSO4溶液的质量_________(增加、不变或减少)_________g。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
25℃时,下列溶液中水的电离程度最小的是
A.0.01 mol/L盐酸 B.0.01 mol/L Na2CO3溶液
C. pH = 4 NaHSO3溶液 D. pH =11氨水
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:选择题
化学与生产和生活密切相关,下列说法正确的是
A.金属钠可以保存在煤油或酒精中,防止在空气中变质
B.石油的裂化和煤的干馏,都属于化学变化
C.等物质的量的乙烯和乙醇完全燃烧时所需氧气的质量相等
D.聚氯乙烯制品易造成白色污染,可采用焚烧法处理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com