
| A、Si具有导电性,可用作半导体材料 |
| B、难熔的Al2O3制成的坩埚,可用于熔融烧碱 |
| C、氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂 |
| D、Cl2和SO2均有漂白性,均可使含有酚酞的NaOH溶液褪色 |


科目:高中化学 来源: 题型:
| A、合成氨工业中及时将NH3液化分离,可加快反应速率,并提高N2、H2的转化率 |
| B、向汽油中添加甲醇后,该混合燃料的热值不变 |
| C、氯碱工业中采用阴离子交换膜法,可防止阴极产生的Cl2和阳极产生的碱反应 |
| D、目前淡化海水的方法有多种,其中蒸馏法历时最久,成本最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加稀硝酸酸化,再加入Ba(NO3)2溶液 |
| B、加BaCl2溶液即可 |
| C、先加盐酸酸化,再加BaCl2溶液 |
| D、加Ba(NO3)2溶液即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
| A、①②③ | B、①③⑤ |
| C、①③⑥ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水可使无色酚酞试纸先变红,后褪色 |
| B、新制的氯水只含Cl2和H2O分子 |
| C、氯水放置数天后,酸性增强 |
| D、光照氯水有气泡逸出,该气体是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
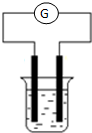 现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下:
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下:| G 实验分组 | 所用金属 | 电子流向 |
| ① | A、Cu | A→Cu |
| ② | C、D | D→C |
| ③ | A、C | C→A |
| ④ | B、Cu | Cu→B |
| ⑤ | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| B、氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| C、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com