
| A、稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| B、氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| C、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |


科目:高中化学 来源: 题型:
| A、Si具有导电性,可用作半导体材料 |
| B、难熔的Al2O3制成的坩埚,可用于熔融烧碱 |
| C、氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂 |
| D、Cl2和SO2均有漂白性,均可使含有酚酞的NaOH溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数目:①=②=③ |
| B、质量关系:①<③<② |
| C、压强关系:①>③>② |
| D、原子数目:②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L氦气含有NA个氦原子 |
| B、20 g重水含有10 NA个电子 |
| C、12.5 mL l6 mol?L-1浓硫酸与足量铜反应,转移电子数为0.2 NA |
| D、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
| B、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
C、用石墨电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| D、铅蓄电池放电时的负极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS溶液的水解方程式:HS-+H2O?H3O++S2- | ||||
B、以金属Pt为阳极电解硫酸铜溶液:2Cu2++2H2O
| ||||
C、硫酸氢铵溶液与少量氢氧化钠溶液混合共热的离子方程式:NH4++OH-
| ||||
| D、强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是吸热反应都需要加热 |
| B、物质的化学变化都伴随着能量变化 |
| C、任何反应中的能量变化都表现为热量变化 |
| D、拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |
查看答案和解析>>
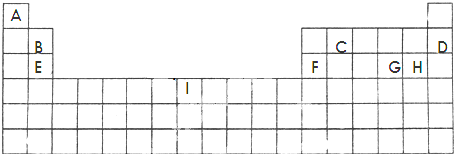
科目:高中化学 来源: 题型:
| 物质 | 组成和结构信息 |
| 甲 | 含有非极性共价键的常见二元离子化合物 |
| 乙 | 含有极性键和非极性键的18e-分子 |
| 丙 | 化学组成为BE,熔点高,可作超硬耐磨涂层材料 |
| 丁 | 化学组成为DBA4的离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com