
| A、凡是吸热反应都需要加热 |
| B、物质的化学变化都伴随着能量变化 |
| C、任何反应中的能量变化都表现为热量变化 |
| D、拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |


科目:高中化学 来源: 题型:
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| B、氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| C、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用盐酸清除水垢CaCO3+2H+=Ca2++CO2↑+H2O |
| B、Fe跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| C、澄清石灰水跟稀盐酸:H++OH-=H2O |
| D、碳酸氢钠溶液跟氢氧化钠溶液反应 HCO3-+OH-=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O、HCOOH、(NH4)2Fe(SO4)2均含有氧,都是氧化物 |
| B、HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 |
| C、赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 |
| D、Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
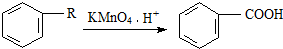
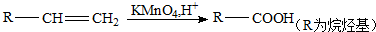 ,芳香烃A的分子式为C8H10,在一定条件下能发生下列转化,B、H属同系物,J是一种常见的高分子塑料.
,芳香烃A的分子式为C8H10,在一定条件下能发生下列转化,B、H属同系物,J是一种常见的高分子塑料.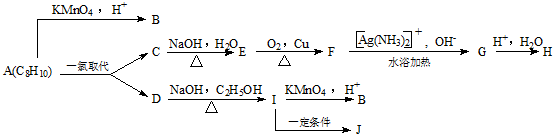
查看答案和解析>>
科目:高中化学 来源: 题型:
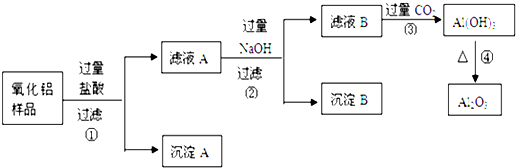
查看答案和解析>>
科目:高中化学 来源: 题型:
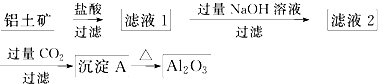
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com