
| A、H2O、HCOOH、(NH4)2Fe(SO4)2均含有氧,都是氧化物 |
| B、HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 |
| C、赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 |
| D、Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物 |


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L氦气含有NA个氦原子 |
| B、20 g重水含有10 NA个电子 |
| C、12.5 mL l6 mol?L-1浓硫酸与足量铜反应,转移电子数为0.2 NA |
| D、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS溶液的水解方程式:HS-+H2O?H3O++S2- | ||||
B、以金属Pt为阳极电解硫酸铜溶液:2Cu2++2H2O
| ||||
C、硫酸氢铵溶液与少量氢氧化钠溶液混合共热的离子方程式:NH4++OH-
| ||||
| D、强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是吸热反应都需要加热 |
| B、物质的化学变化都伴随着能量变化 |
| C、任何反应中的能量变化都表现为热量变化 |
| D、拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
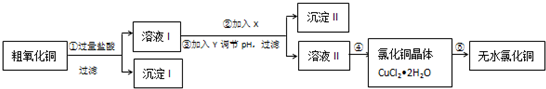
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
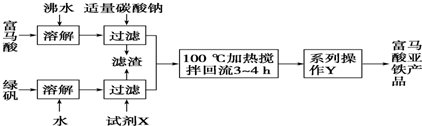
 )是一种限量使用的铁强化剂.
)是一种限量使用的铁强化剂.| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5g,加入稀硫酸25mL,用水稀释至50mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | |
| ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com