
【题目】为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。

(1)碘在周期表中的位置为__________________;
(2)碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
(3)混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
(4)试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
(5)如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
【答案】
(1)第五周期 第ⅦA族
(2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
(3)促进氯气从反应混合物中逸出 稀盐酸 盐酸能还原已生成的碘酸氢钾
(4)KOH KH(IO3)2+KOH=2KIO3+H2O
(5)反应产生的氯气能与氢氧化钾溶液反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾
【解析】
试题分析:(1)碘的原子序数是127,在周期表中的位置为第五周期第第ⅦA族;
(2)根据方程式可知反应中I的化合价从0价升高到+5价,失去5个电子。氯酸钾中Cl元素化合价从+5价降低到0价和—1价,两种还原产物所得电子的数目相同,所以根据电子得失守恒可知配平后的方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(3)混合反应后,用稀酸酸化,溶液酸性增强,因此其作用是促进氯气从反应混合物中逸出;由于盐酸能还原已生成的碘酸氢钾,所以不能选择盐酸;
(4)晶体①为KH(IO3)2,把晶体从溶液中过滤出来,洗涤干净,然后用水溶解得到KH(IO3)2的溶液,要把酸式盐变为正盐KIO3,就要加碱来调节溶液的pH值。为了不引入新的杂质,所以要用KOH。该反应的方程式为KH(IO3)2+KOH=2KIO3+H2O;
(5)反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑产生的氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾。


科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温恒容下2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s)。2 min 时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
xC(g)+2D(s)。2 min 时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,A的转化率为________。
(2)x=________。
(3)下列各项可作为该反应达到平衡状态的标志的是________(填各项代号)
A.压强不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.A的消耗速率与B的消耗速率之比为2:1
Ⅱ.一定条件下,可逆反应A2(g)+B2(g) ![]() 2C(g)达到平衡时,各物质的平衡浓度分别为c(A2)=0.4mol·L—1;c(B2)=0.1mol·L—1;c(C)=1.6mol·L—1。
2C(g)达到平衡时,各物质的平衡浓度分别为c(A2)=0.4mol·L—1;c(B2)=0.1mol·L—1;c(C)=1.6mol·L—1。
(1)若反应开始时,反应容器中未加入B,10s后达到平衡,则10s内用C的浓度变化表示的化学反应速率为_____________。
(2)若A2、B2、C的初始浓度分别用a、b、c表示(mol·L—1),则:a、b应满足的关系是 。a的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活息息相关。下列说法不正确的是
A.玻璃、水晶和陶瓷都是传统硅酸盐材料
B.可溶性铝盐和铁盐可用作净水剂
C.SO2和NO都能形成酸雨而破坏环境
D.CO2和CH4都是引起温室效应的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
[Zn(CN)4]2–在水溶液中与HCHO发生如下反应:
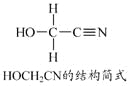
4HCHO+[Zn(CN)4]2–+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2–中Zn2+与CN–的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2–的结构可用示意图表示为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2II
CO(g)+H2O(g)ΔH2II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=;反应II的ΔH2=kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A. 上述反应在较高温度下才能自发进行
B. 该反应的正反应活化能小于逆反应活化能
C. 该反应中,断裂化学键的总键能大于形成化学键的总键能
D. 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
(1) X、Y、Z的第一电离能从大到小的顺序是___________(用元素符号表示,下同)。
(2)写出W的价电子排布式_____________,W同周期的元素中,与W原子最外层电子数相等的元素还有____________。
(3)根据等电子体原理,可知化合物XZ的结构式是__________, YZ2-的VSEPR模型是___________。
(4) X、Y、Z的.简单氮化物的键角从大到小的顺序是_______(用化学式表示),原因是________________
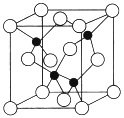
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式___________,该物质硬度大,推测该物质为_________晶体。其中Y元素的杂化方式是______。
(6)U的晶体属立方晶系,其晶胞边长为405pm ,密度是2.70g/cm3,通过计算确定其晶胞的类型_____(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com