
下列关于高分子化合物的说法中,正确的是
A. 多糖、油脂、蛋白质都是天然有机高分子化合物
B. 塑料、合成纤维和橡胶都属于合成高分子材料
C. 高聚物 的形成过程为加聚反应
的形成过程为加聚反应
D. 合成酚醛树脂 的单体是苯酚和甲醇
的单体是苯酚和甲醇
科目:高中化学 来源: 题型:
在标准状况下有:①6.72 L CH4,②3.01×1023个HCl分子,③13.6 g H2S,④0.2 mol NH3。下列对这四种气体的描述正确的是 ( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abd D.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2 和CO的燃烧热(△H)分别为?890.3kJ?mol?1、?285. 8 kJ?mol?1和?283.0 kJ?mol?1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):

①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5?6min和15?16 min时平均反应速率的大小:v(5?6)
v(15?16)(填“<”、“>”或“=”),原因是 。
③计算反应在第8 min时的平衡常数K= ;(列出计算过程,结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化合物的结构(键线式)及球棍模型如下:
|
|
|
该有机分子的核磁共振波谱图如下(单位是ppm)。

下列关于该有机物的叙述正确的是
A.该有机物不同化学环境的氢原子有8种 B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为-CH3 D.该有机物不可能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,实现零排放。下列反应类型一定符合这一要求的是
①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤加聚反应 ⑥氧化反应
A. ①④ B. ②③ C. ⑤⑥ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
NM—3和D—58是正处于临床试验阶段的小分子抗癌药物,结构如下。关于NM—3和D—58的叙述,正确的是

A. NM—3和D—58互为同分异构体
B. NM—3和D—58都能与溴水反应,反应类型完全相同
C. 两者都能与NaOH溶液反应,且相同物质的量的NM—3和D—58消耗的NaOH的量相同
D. 都能和H2发生加成反应,且相同物质的量的NM—3和D—58最多消耗的H2物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①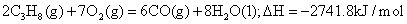
②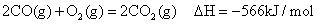
(1)写出表示丙烷燃烧热的热化学方程式________________________
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
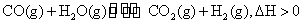
①下列事实能说明该反应达到平衡的是( )。
a. 体系中的压强不发生变化
b. 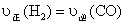
c. 混合气体的平均相对分子质量不发生变化
d. CO2的浓度不再发生变化
②在某温度下,反应物的起始浓度分别为: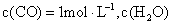 =2.4mol·
=2.4mol·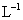 ;达到平衡后,CO的转化率为60%,该温度下的化学平衡常数为___________;
;达到平衡后,CO的转化率为60%,该温度下的化学平衡常数为___________;
③CO2可用足量NaOH溶液吸收得到Na2CO3,用离子方程式解释其水溶液呈碱性的原因_________________。该溶液中离子浓度由大到小的顺序为_____________。
(3)可利用丙烷设计一个燃料电池,用KOH作电解质溶液,多孔石墨作电极,该电池负极反应式为:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是
A.同主族元素的简单阴离子还原性越强,则对应元素的非金属性越强
B.第二周期元素从左到右,最高正价从+1递增到+7
C.IA族与ⅦA族元素间可形成共价化合物或离子化合物
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的X、Y、Z、M、W为五种短周期元素。已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76 g·L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应。下列说法不正确的是 ( )
A.M的单质可用于从钛、锆等金属的氯化物中置换出钛、锆等单质
B.由X、Y、Z三种元素形成的某种化合物的水溶液,可能呈碱性或酸性
C.由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同
D.含有W阳离子的某种盐,可用作净水剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com