
分析 (1)根据含有自由移动的带电微粒(如离子、电子)的物质能导电;
(2)电解质是熔融态或水溶液状态下能导电的化合物,该定义的前提必须是化合物;
(3)非电解质是在水溶液里或熔融状态下都不能导电的化合物,该定义的前提必须是化合物;
(4)水溶液中部分电离的电解质为弱电解质;
(5)酸、强酸若碱盐、酸式盐电离程度大于其水解程度等物质的溶液显酸性;
(6)碱、强碱弱酸盐水解溶液显碱性.
解答 解:①NH4Cl(s)溶于水导电属于电解质,本身不能导电,溶于水铵根离子水解溶液显酸性;
②C2H5OH(l)不能电离属于非电解质,不能导电,水溶液呈中性;
③氨水是一水合氨的水溶液,不是电解质,溶液导电,一水合氨电离出氢氧根离子溶液显碱性;
④蔗糖(s)属于非电解质,不能导电,溶于水溶液呈中性;
⑤NaOH溶液是电解质溶液,不是电解质,溶液导电,呈碱性;
⑥BaSO4(s)是盐属于电解质,不能导电,不溶于水;
⑦熔融Na2CO3,能电离出离子,导电,属于电解质,溶于水溶液显碱性;
⑧液态SO3,不能电离不能导电,属于非电解质,溶于水现场临时溶液显酸性;
⑨冰醋酸,溶于水导电,属于电解质,溶于水溶液导电,溶液显酸性;
⑩氯气属于单质,不是电解质、非电解质,溶于水溶液显酸性,溶液导电;
(1)能导电的是③⑤⑦,故答案为:③⑤⑦;
(2)属于电解质的是①⑥⑦⑨,故答案为:①⑥⑦⑨;
(3)属于非电解质的是②④⑧,故答案为:②④⑧;
(4)属于弱电解质的是⑨,故答案为:⑨;
(5)水溶液呈酸性的是:①⑧⑨⑩,故答案为:①⑧⑨⑩;
(6)水溶液呈碱性的是③⑤⑦,故答案为:③⑤⑦.
点评 本题考查了电解质溶液导电的原因及电解质、非电解质、弱电解质的定义,能导电的不一定是电解质,如硝酸钾溶液;电解质不一定能导电,如硫酸铜晶体.,注意盐类水解的应用和溶液酸碱性的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Fe2+、Ba2+、NO3- | B. | Na+、K+、HCO3-、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Fe3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
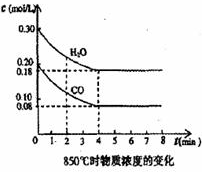 在一体积为 10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图:
在一体积为 10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的浓KOH溶液中并加热:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物 | |
| B. | 下雪后,常用播撒NaCl颗粒方法来防止道路结冰 | |
| C. | 用活性炭为糖浆脱色和用SO2漂白纸浆的原理不同 | |
| D. | 在医学上用BaSO4做钡餐,是因为Ba2+对人体无毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com