

分析 (1)由图象可知反应的热化学方程式为分别为①CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+206.2kJ•mol-1、②CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+165.0kJ•mol-1,②×2-①可得反应的热化学方程式;
(2)①使甲醇体积分数增大,应使平衡正向移动;
②已知3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),平衡常数为生成物与反应物浓度幂之积的比值;由图可知n(Mn)/n(Cu)约为2.0时,转化率选择性最大;
③10s到达平衡后测得CH3OH 0.04mol,CH3OCH30.08mol,由方程式可计算反应的甲醇的物质的量,进而计算反应速率,计算平衡常数,可判断反应进行的方向.
解答 解:(1)由图象可知反应的热化学方程式为分别为①CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+206.2kJ•mol-1、②CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+165.0kJ•mol-1,②×2-①可得反应的热化学方程式为CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+123.8kJ•mol-1,
故答案为:+123.8kJ•mol-1;
(2)①A.升高温度,平衡逆向移动,甲醇体积分数减小,故A错误;
B.将CH3OH(g)从体系中分离,虽然平衡正向移动,但甲醇体积分数减小,故B错误;
C.充入N2使体系总压强增大,但参加反应的气体的浓度不变,平衡不移动,甲醇体积分数不变,故C错误;
D.再充入1mol CO和3mol H2,平衡正向移动,甲醇体积分数增大,故D正确.
故答案为:D;
②已知3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),则K=$\frac{c(C{H}_{3}OC{H}_{3})•c(C{O}_{2})}{{c}^{3}({H}_{2})•{c}^{3}(CO)}$,由图可知,n(Mn)/n(Cu)约为2.0时,CO转化率较大,转化率选择性最大,最有利于二甲醚的合成,
故答案为:$\frac{c(C{H}_{3}OC{H}_{3})•c(C{O}_{2})}{{c}^{3}({H}_{2})•{c}^{3}(CO)}$; 2.0;
③2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始(mol) 0.2 0 0
转化(mol)0.16 0.08 0.08
平衡(mol)0.04 0.08 0.08
则甲醇表示反应在10s内的平均反应速率为$\frac{\frac{0.16mol}{2L}}{10s}$=0.008mol•L-1•s-1,
体积为2L,则K=$\frac{0.04×0.04}{0.0{2}^{2}}$=4,
相同条件下起始时向该容器中充入CH3OH 0.15mol、CH3OCH30.15mol、和H2O 0.10mol,则$\frac{0.075×0.050}{0.07{5}^{2}}$=0.67<4,
则反应向正反应方向移动,
故答案为:0.008mol•L-1•s-1;正反应.
点评 本题化学平衡图象为载体考查化学平衡计算以及反应热与焓变知识,为高频考点,把握图中转化率、合成二甲醚的条件等为解答的关键,侧重分析与应用能力的考查,注意横坐标的含义,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 molCH3COOK含有3×6.02×1023个氢元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时(s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=$\frac{0.01}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
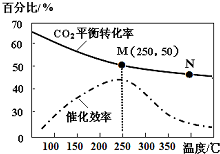 综合利用CO2、CO对构建低碳社会有重要意义.
综合利用CO2、CO对构建低碳社会有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com