
 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:| n(NaOH) |
| 0.05L |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 6 |
| 1 |
| 6 |
| 0.07mol |
| 0.05L |


科目:高中化学 来源: 题型:
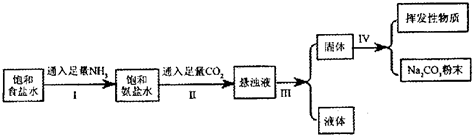
| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
查看答案和解析>>
科目:高中化学 来源:2013届湖南省邵阳县石齐学校高三第一周考试化学试卷(带解析) 题型:实验题
(18分)某兴趣小组欲从工业食盐中精炼精盐,并配制NaCl溶液,请回答下列问题:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B
(2)实验室提纯粗盐的实验操作依次为:
取样、 、沉淀、过滤、 、冷却结晶、烘干。
(3)实验室配制500 mL 0.1mol/L的NaCl溶液,具体操作步骤为:①在天平上称取一定质量的NaCl,把它放在烧杯中,用适量的蒸馏水使其完全溶解;②把制得的溶液小心的注入500 mL的容量瓶中;③继续向容量瓶中滴加蒸馏水至液面距刻度线1~2 cm处时,改用胶头滴管小心滴加,直到溶液的凹液面恰好与刻度线相切为止;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都转入容量瓶中,并轻轻摇匀;⑤将容量瓶塞好,充分摇匀。试填写下列空白。
①应该称取的NaCl的质量为________,上述操作的正确顺序是____________;
②本实验用到的仪器除玻璃棒、托盘天平、药匙、烧杯外还需要的有___________________、______________________,
③观察容量瓶中的液面时,若俯视刻度线,会使所配的溶液的浓度________(填“偏高”“偏低”或“无影响”,下同)。没有进行操作④,会________;
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三考前模拟化学试卷(解析版) 题型:计算题
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaC1O;氯气与热的氢氧化钠溶液反应可生成NaC1O和NaC1O3。②在酸性较弱时KI只能被NaC1O氧化,在酸性较强时亦能被NaC1O3氧化。
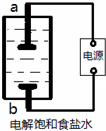
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为 (填“阳极”或“阴极”)。生成NaClO的离子方程式为 。

(2)该小组将0.784 L(标准状况)Cl2通入50.00 mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0 mL。
①取稀释后的溶液25.00 mL用醋酸酸化,加入过量KI溶液。用0.2000 mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00 mL时恰好到达终点。
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00 mL。
①操作②中氯酸钠与碘化钾反应的离子方程式为 。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为 。
③计算氢氧化钠溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年宁夏高三第一次月考理综化学试卷(解析版) 题型:实验题
(15分)某兴趣小组欲从工业食盐中精炼精盐,并配制NaCl溶液,请回答下列问题:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B
(2)实验室提纯粗盐的实验操作依次为:
取样、 、沉淀、 、 、冷却结晶、烘干。
(3)实验室配制500 mL 0.1mol/L的NaCl溶液,具体操作步骤为:①在天平上称取一定质量的NaCl,把它放在烧杯中,用适量的蒸馏水使其完全溶解;②把制得的溶液小心的注入500 mL的容量瓶中;③继续向容量瓶中滴加蒸馏水至液面距刻度线1~2 cm处时,改用胶头滴管小心滴加,直到溶液的凹液面恰好与刻度线相切为止;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都转入容量瓶中,并轻轻摇匀;⑤将容量瓶塞好,充分摇匀。试填写下列空白。
①应该称取的NaCl的质量为________,上述操作的正确顺序是____________;
②本实验用到的仪器有:玻璃棒、_____________________________________________
________________________________________________________________________,
③ 观察容量瓶中的液面时,若俯视刻度线,会使所配的溶液的浓度________(填“偏高”“偏低”或“无影响”,下同);没有进行操作④,会________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com