
【题目】某兴趣小组在复习铁的冶炼时,在参考资料上发现以下一段文字:已知在不同的温度下,一氧化碳与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和二氧化碳,他们不禁产生了疑问:一氧化碳与氧化铁反应生成的黑色物质真的是铁粉吗?于是他们进行了以下探究:
[查阅资料]
资料一:铁粉和四氧化三铁粉末能被磁铁吸引而氧化亚铁(黑色)不能;
资料二:四氧化三铁中铁元素有+2、+3两种化合价,其化学式可用FeO·Fe2O3的形式表示。
[提出猜想]黑色物质可能是四氧化三铁、氧化亚铁和铁粉中的一种或几种。
[进行实验]兴趣小组收集了一氧化碳与氧化铁反应生成的黑色物质进行了下列实验:
实验方案 | 实验现象 | |
甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变为黄绿色 |
丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
[实验结论]
(1)甲实验现象说明黑色物质中没有_______,乙、丙实验现象说明黑色物质中没有______;
(2)生成的黑色物质应为四氧化三铁;
(3)写出黑色粉末和热的盐酸反应的化学方程式_______________________________。
[拓展研究]
同学们对四氧化三铁产生了兴趣,从参考资料中找到氧化沉淀法生产复印用高档四氧化三铁粉的工艺流程简图。
[生产流程]
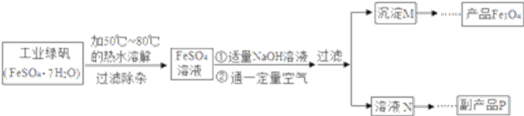
[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料二:氢氧化亚铁受氧气氧化反应原理为4Fe(OH)2+2H2O+O2===4Fe(OH)3
资料三:获得四氧化三铁的反应原理为Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
[问题讨论]
(1)溶解时,用50 ℃至80 ℃的热水目的是____________________________________。
(2)写出加入适量氢氧化钠溶液时发生反应的化学方程式________________________。
(3)上述过程中,要控制“通一定量空气”的目的是____________________________。
(4)要使四氧化三铁的产率最高,则上述流程中产生的氢氧化亚铁和氢氧化铁的最佳质量比为______________。
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→_____→_____→d。_______
a.过滤
b.加热浓缩
c.冷却结晶
d.晶体加热至完全失去结晶水
[组成确定]
为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究。
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:氧化铁和一氧化碳反应是随温度升高而逐步进行的,先生成四氧化三铁,再生成氧化亚铁(黑色),最后生成铁。
[提出猜想]
四氧化三铁中可能含有的杂质是氧化铁和氧化亚铁中的一种或两种。
[实验设计]
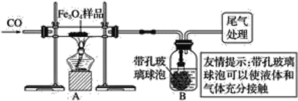
同学们称取了23.28 g该四氧化三铁样品进行了下列实验:
[实验分析]
因探究思路不同,兴趣小组分成甲、乙两小组。
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该四氧化三铁样品中的杂质,B中的最佳试剂是_________(填序号)。
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,一氧化碳气体除作为反应物外,还能起到的作用是:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;
③_____________________________________________。
(3)乙组同学认为B装置反应前后的质量差会偏小而影响计算、分析,你认为他们的理由是_______________________________________________。
乙组:
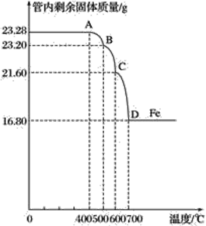
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图):
(1)写出BC段发生反应的化学方程式______________________________。
(2)通过计算确定:该四氧化三铁样品中含有的杂质是__________,其中含四氧化三铁的质量是____g。(不需要写过程)
【答案】氧化亚铁 铁 Fe3O4+8HCl=FeCl2+2FeCl3+4H2O 在50 ℃~80 ℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率 2NaOH+FeSO4=Fe(OH)2↓+Na2SO4 防止氢氧化亚铁完全转化为氢氧化铁 90∶214(或45∶107) c a ② ③将装置中的二氧化碳通入氢氧化钠溶液中 一氧化碳从B中溶液里逸出时会带出部分水蒸气 Fe3O4+CO![]() 3FeO+CO2 氧化铁 20.88 g
3FeO+CO2 氧化铁 20.88 g
【解析】
[实验结论](1)根据题意FeO不能被磁铁吸引分析甲,根据铁能与盐酸、硫酸铜反应的性质分析乙、丙;
(3)根据金属氧化物与盐酸生盐和水,写出反应的方程式;
[问题讨论](1)根据硫酸亚铁的溶解度与温度的关系进行解答;
(2)根据碱和盐反应进行解答;
(3)根据反应条件可以影响反应的产物进行解答;
(4)根据质量守恒定律可知Fe(OH)2和Fe(OH)3的最佳质量比;
(5)根据硫酸钠的溶解性以及固体物质的分离方法进行解答;
【实验分析】
甲组:(1)根据氢氧化钠溶液用于吸收二氧化碳进行解答;
(2)根据一氧化碳还原四氧化三铁的作用进行解答;
(3)根据一氧化碳从B装置中流出要带走水蒸气进行解答;
乙组:(1)根据反应进行程度判断;
(2)根据氧元素的含量进行判断.根据铁元素质量守恒计算。
[实验结论]:
(1)实验甲中看到黑色物质全部被磁铁吸引,说明没有氧化亚铁;实验丙中取少量黑色物质加入硫酸铜溶液中无任何现象,说明没有铁;
(3)根据实验可知黑色固体为四氧化三铁,和盐酸反应生成氯化铁、氯化亚铁和水。黑色粉末和热的盐酸反应的化学方程式:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;
[问题讨论]:
(1)根据图表中的信息可知,在50 ℃至80 ℃的热水中,硫酸亚铁的溶解度较大,利于溶解更多的硫酸亚铁,提高产率;
(2)氢氧化钠和硫酸亚铁反应生成氢氧化亚铁和硫酸钠:2NaOH+FeSO4=Fe(OH)2↓+Na2SO4 ;
(3)上述过程中,要控制“通一定量空气”的目的是控制氢氧化亚铁转化为氢氧化铁的量,防止氢氧化亚铁完全转化为氢氧化铁;
(4)要使四氧化三铁的产率最高,上述流程中产生的氢氧化亚铁与氢氧化铁的物质的量之比为1∶2,最佳质量比为90∶214(或45∶107);
(5)根据硫酸钠晶体的溶解度随温度的升高而增大,采用加热浓缩、冷却结晶的方法,再过滤,晶体加热至完全失去结晶水,得到硫酸钠,故答案为:c a ;
[实验结论]
甲组:(1)氢氧化钙的溶解性很小,不能保证把生成的二氧化碳全部吸收;二氧化碳溶解水的能力也不大,不能保证把生成的二氧化碳全部吸收;稀盐酸和二氧化碳不反应;只有氢氧化钠溶液保证把生成的二氧化碳全部吸收,故选用氢氧化钠浓溶液,即选②;
(2)上述实验过程中,一氧化碳气体除作为反应物外,还能起到的作用是:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;
③将装置中的二氧化碳通入氢氧化钠溶液中;
(3)一氧化碳从B中溶液里逸出时会带出部分水蒸气,而影响计算样品中杂质的质量;
乙组:(1)BC段发生反应的化学方程式:Fe3O4+CO![]() 3FeO+CO2;
3FeO+CO2;
(2)到700 ℃时只剩下铁,即此时氧化铁被一氧化碳还原为铁单质,
混合物中铁元素的质量分数=![]() ×100%=72.16%;
×100%=72.16%;
四氧化三铁铁元素的质量分数=![]() ×100%=72.4%;
×100%=72.4%;
氧化亚铁铁元素的质量分数=![]() ×100%≈77.8%;
×100%≈77.8%;
氧化铁铁元素的质量分数=![]() ×100%=70%,
×100%=70%,
所以该四氧化三铁样品中含有的杂质是氧化铁;
设混合物中含四氧化三铁的质量为x,则x×![]() ×100%+(23.28 g-x)×
×100%+(23.28 g-x)×![]() ×100%=16.80g,x=20.88g。
×100%=16.80g,x=20.88g。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
![]()
A. 氢化物的稳定性:R<Q<T
B. T的单质是一种良好的半导体材料
C. Q、R的简单氢化物分子所含质子数、电子数与氖原子相同
D. T、W的最高价氧化物的水化物的酸性W强于T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及图1所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。

(1)装置乙的作用是______________________________________。为防止污染空气,尾气中含有的______________需要进行吸收处理。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有________________、洗涤、灼烧。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究。取加热了t1min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌,随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示,则曲线c对应的溶液中的离子是______________________(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是__________。
(4)若取10.5 g NaHCO3固体,加热了t1min后,剩余固体的质量为7.4 g。如果把此剩余固体全部加入到200 mL 1 mol·L-1的盐酸中,则充分反应后溶液中H+的物质的量浓度为__________(设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物应用非常广泛。下列有关说法正确的是( )
A.地下钢管常用牺牲阳极的阴极保护法,阳极材料可用铜
B.反应Cu2S+O2![]() 2Cu+SO2,每生成1molCu转移电子数为6.02×1023
2Cu+SO2,每生成1molCu转移电子数为6.02×1023
C.反应2Cu+CO2+H2O+O2=Cu2(OH)2CO3室温下能自发进行,该反应的ΔH<0
D.室温下,Ksp[Fe(OH)3]=4×10-38,pH=4的含Fe3+溶液中,c(Fe3+)≤4×10-8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向NaHSO3溶液中滴加足量Ba(OH)2溶液,出现白色沉淀,再加入足量盐酸,沉淀全部溶解 | NaHSO3未被氧化 |
B | 向3mLFe(NO3)3溶液中滴加几滴HI溶液,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | I-的还原性比Fe2+的强 |
C | 向MgSO4、CuSO4的混合稀溶液中滴入1滴稀NaOH溶液,有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
D | 用精密pH试纸测得:浓度均为0.1mol·L-1的NH4HCO3溶液、HCOONa溶液的pH分别为7.8、10.0 | H2CO3电离出H+的能力比HCOOH的强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X,Y,Z,发生反应mX(g)+nY(g) pZ(g) ΔH=QkJ·mol-1。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。下列说法不正确的是

A.![]() B.体积不变,温度升高,平衡向逆反应方向移动
B.体积不变,温度升高,平衡向逆反应方向移动
C.Q<0D.温度不变,压强增大,Y的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
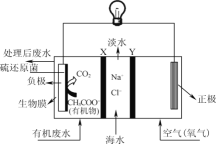
A.该装置工作时,电能转化为化学能
B.该装置可以在高温下工作
C.X为阳离子交换膜,Y为阴离子交换膜
D.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 将稀硝酸加入过量铁粉中,充分反应后滴加 | 有气体生成,溶液呈血红色 | 稀硝酸将 |
B | 将铜粉加 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
C |
| 溶液变红 |
质 |
D | 取少量绿矾 | 溶液未变红色 | 绿矾未因氧化而变质 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com