
【题目】现有A元素的一种同位素,比镤91—239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A.第3周期第ⅠA族B.第4周期第ⅠA族
C.第5周期第ⅠA族D.第3周期第ⅡA族
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知b、c两种元素的单质是空气的主要成分,d原子的最外层电子数与Ne原子的最外层电子数相差2。下列说法正确的是
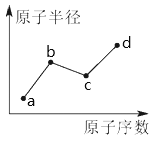
A. b、c、d处于同一周期
B. 氢化物的稳定性:d>c
C. a、c、d可形成强弱程度不同的含氧酸
D. b、d的最简单氢化物可相互化合形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
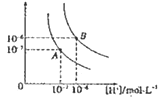
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 25℃时某溶液中由水电离产生的c( H+)> =1×10-ll molL-1,则该溶液的pH可能是11或3
C. 将pH = 9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100 ℃的恒温,混合溶液的PH=7,则此Ba(OH)2的溶液和盐酸的体积比为10:1
D. 100℃时,某 NaS04 溶液中 c(S042- ) =5 ×10 -4mol L-1,则溶液中 c(Na+): c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为![]()
B.物质的量浓度c可表示为![]()
C.溶液的质量分数w%可表示为![]()
D.相对分子质量Mr可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
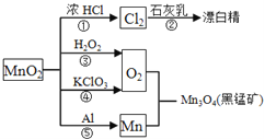
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是:
A. 在一个氧化还原反应中,氧化剂的氧化性强于氧化产物
B. 在一个氧化还原反应中,还原产物的还原性弱于还原剂
C. amolH2SO4中,含有b个氧原子,则阿伏加德罗常数可以表示为b/4a/mol
D. 配制0.05mol/LNa2CO3溶液90mL,需Na2CO3固体5.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 所有主族中都有非金属元素 B. 同周期元素中,VIA族元素的原子半径最大
C. 过渡元素都是金属元素 D. VIA族元素的原子,其半径越大,越容易得到电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )

A. 在t℃时,Ag2CrO4的Ksp为1×10-8
B. 在饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C. 在t℃时,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
D. 在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法” 生产纯碱和化肥NH4Cl,工艺流程如下图所示.下列有关说法正确的是
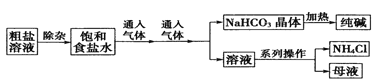
A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com