
【题目】下列说法不正确的是:
A. 在一个氧化还原反应中,氧化剂的氧化性强于氧化产物
B. 在一个氧化还原反应中,还原产物的还原性弱于还原剂
C. amolH2SO4中,含有b个氧原子,则阿伏加德罗常数可以表示为b/4a/mol
D. 配制0.05mol/LNa2CO3溶液90mL,需Na2CO3固体5.3g
科目:高中化学 来源: 题型:
【题目】下列两种化合物的结构或性质描述正确的是

A. 两种物质可用滴有酚酞的NaOH溶液来区分
B. 两种物质的分子式皆为C10H12O2,二者互为同分异构体
C. 两种物质均能发生加成反应、取代反应、酯化反应、氧化反应
D. 两物质都含有不饱和键,因此都能使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)几种共价键的键能如下表所示:
化学键 | O=O | H—H | O—H |
键能(kJ/mol) | 496 | 436 | 462 |
已知:O2(g)+2C(s)=2CO(g) △H= -220kJ·mol-1,则H2O(g)+C(s) = CO(g)+H2(g) △H=___ kJ·mol-1。
(2)200℃时,将物质的量均为1mol的CO2和C(s)加入2L的密闭容器中,在一定条件下发生反应:CO2(g)+C(s) ![]() 2CO(g) △H,平衡时CO的体积分数为40%。
2CO(g) △H,平衡时CO的体积分数为40%。
①下列事实能够说明该反应达到平衡状态的是____________。
a.混合气体的平均相对分子质量不变
b.该反应的△H不变
c. CO2和CO的生成速率相等
d.混合气体的密度不变
②达到平衡时CO2的转化率为__________________。
③若在300°C时,将物质的量均为lmol的CO2和C(s)加入1L的密闭容器中,平衡时CO的体积分数为50%,则该反应的△H_____0 (填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A元素的一种同位素,比镤91—239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A.第3周期第ⅠA族B.第4周期第ⅠA族
C.第5周期第ⅠA族D.第3周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______,制得等量H2所需能量较少的是________。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=________%,反应平衡常数K=________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2_______α1,该反应的ΔH________0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知X为一种常见酸的浓溶液,能使蔗糖粉末变黑,A与X反应的转化关系如图所示,其中反应条件及部分产物均己略去,则下列有关说法正确的是
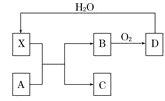
A. X使蔗糖变黑的现象主要体现了 X的强氧化性
B. 若A为铁,则A与X在室温下不会反应
C. 若A为碳单质,则将C通入少量的澄淸石灰水中,溶液仍然澄清
D. 工业上在高温、常压和使用催化剂的条件下,可以使B完全转化为D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)溶质的质量分数为b%的KOH溶液,经加热蒸发去ag水后,质量分数变成 2b%,体积为VmL,则此时溶液的物质的量浓度为___________。(答案必须为最简形式)
(2)将6mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成3mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为__________mL。
(3)密度为1.19g/cm3的盐酸,质量分数为25%。该盐酸用等体积的水稀释后,所得溶液中溶质的质量分数_______(填“大于”、“小于”或“等于”)12.5%。
(4)已知20℃时,饱和NaCl溶液的密度为ρg/cm3,物质的量浓度为c mol/L,则饱和NaCl溶液的溶解度为_________g。(答案必须为最简形式)
(5)相同质量的NO2和N2O4的质子数之比为_______,电子数之比为_______________。
(6)请用单线桥表示化学方程式CaH2+2H2O=Ca(OH)2+2H2↑电子转移的方向和数目___________。
(7)若将过量的NaOH溶液加入NH4HCO3溶液中,则反应的化学方程式__________________,若将NaOH溶液加入过量的NH4HCO3溶液中,则反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 元素的种类由最外层电子数决定
B. 化学键是存在于分子、原子和离子间的作用力
C. 原子的种类由原子核内质子数与中子数共同决定
D. 化学反应速率可以决定反应的限度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com