
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______,制得等量H2所需能量较少的是________。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=________%,反应平衡常数K=________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2_______α1,该反应的ΔH________0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A.H2S B.CO2 C.COS D.N2
【答案】 D H2O(l)===H2(g)+O2(g) ΔH=+286 kJ·mol-1 H2S(g)===H2(g)+S(s) ΔH=+20 kJ·mol-1 系统(Ⅱ) 2.5 2.8×10-3 > > B
【解析】(1)根据盖斯定律,把系统(Ⅰ)的三个热化学方程式相加可得:H2O(l)=H2(g)+![]() O2(g) ΔH=286 kJmol-1;把系统(Ⅱ)的三个热化学方程式相加可得:H2S(g)=H2(g)+S(s) ΔH=20 kJmol-1;由上述两个热化学方程式可得,制得1mol H2,系统(Ⅰ)需要吸收286kJ能量,系统(Ⅱ) 需要吸收20kJ能量,所以制得等量H2所需能量较少的是系统(Ⅱ)。
O2(g) ΔH=286 kJmol-1;把系统(Ⅱ)的三个热化学方程式相加可得:H2S(g)=H2(g)+S(s) ΔH=20 kJmol-1;由上述两个热化学方程式可得,制得1mol H2,系统(Ⅰ)需要吸收286kJ能量,系统(Ⅱ) 需要吸收20kJ能量,所以制得等量H2所需能量较少的是系统(Ⅱ)。
(2)设反应的H2S物质的量为x,由题意列三段式得:
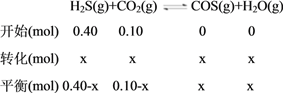
因为反应平衡后水的物质的量分数为0.02,所以![]() =0.02,解得x=0.01;①H2S的平衡转化率α1=0.01÷0.40×100%=2.5%;反应平衡常数K=
=0.02,解得x=0.01;①H2S的平衡转化率α1=0.01÷0.40×100%=2.5%;反应平衡常数K= =
=![]() ≈2.849×10-3(或2.8×10-3或2.85×10-3)。
≈2.849×10-3(或2.8×10-3或2.85×10-3)。
②由已知,升温,水的物质的量分数增大,所以升温时平衡正向移动,故α2>α1,ΔH>0。
③A项,再充入H2S,平衡正向移动,使CO2转化率增大,根据化学平衡移动原理,H2S的转化率减小,故A错误;B项,再充入CO2,平衡正向移动,在不改变H2S初始量的前提下,使H2S转化率增大,故B正确;C项,再充入COS,平衡逆向移动,使H2S的转化率减小,故C错误;D项,再充入N2,与该反应无关,平衡不移动,H2S的转化率不变,故D错误。综上选B。


科目:高中化学 来源: 题型:
【题目】下列有关物质结构的描述正确的是
A. 甲苯分子中的所有原子可能共平面 B. CH2=CH-C6H5分子中的所有原子可能共平面
C. 二氯甲烷分子具有正四面体结构 D. 正戊烷分子中5个碳原子可以在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里要配制400mL0.2mol/L的硫酸钠溶液。实验步骤如下:
A.在天平上称出_______g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。
B.把得到的溶液冷却后小心地沿着__________注入_______________ 中。
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用________小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切。
E.将瓶塞塞紧,充分摇匀。
F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(1) 请填写上述空白处。
(2) 下列情况会使所配溶液浓度偏低的是___________(填序号)。

a.某同学定容时观察液面的情况如图所示
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线
d.B操作时将少量液体洒到外面
e.容量瓶用前内壁沾有水珠
(3) 如果实验室用18mol/L的浓硫酸配制3. 6mol·L-1的稀硫酸250mL。计算所需浓硫酸的体积为___________mL,在实验时应用_________量取浓硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象所表示的化学知识中不正确的是
A. 分散系的分类![]()
B. 稀释浓氢氧化钠溶液的过程
C. 向碳酸钠溶液中逐滴滴加盐酸
D. 向盐酸和氯化镁混合溶液中滴加氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是:
A. 在一个氧化还原反应中,氧化剂的氧化性强于氧化产物
B. 在一个氧化还原反应中,还原产物的还原性弱于还原剂
C. amolH2SO4中,含有b个氧原子,则阿伏加德罗常数可以表示为b/4a/mol
D. 配制0.05mol/LNa2CO3溶液90mL,需Na2CO3固体5.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是

A. 原溶液中NaOH的物质的量为0.75mol
B. 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C. 通入CO2后所得的溶液中含有2.5×10-3mol NaHCO3
D. 原溶液通入CO2标准状况下为112mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电解NaCl水溶液,下列叙述正确的是 ( )
A. 电解时在阳极得到氯气,在阴极得到金属钠
B. 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C. 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D. 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡.
(1)醋酸是常见的弱酸.
① 醋酸在水溶液中的电离方程式为________________________________________________;
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号) 。
A.滴加少量浓盐酸 B.微热溶液 C.加水稀释 D.加入少量醋酸钠晶体
(2)用0.1 molL-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 molL-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

① 滴定醋酸的曲线是______________(填“I”或“Ⅱ”);
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____________________;
③ V1和V2的关系:V1 _____ V2(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com