
【题目】下列图象所表示的化学知识中不正确的是
A. 分散系的分类![]()
B. 稀释浓氢氧化钠溶液的过程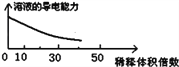
C. 向碳酸钠溶液中逐滴滴加盐酸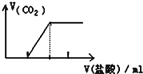
D. 向盐酸和氯化镁混合溶液中滴加氢氧化钠溶液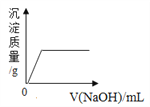
科目:高中化学 来源: 题型:
【题目】用下列方程式均可制得氧气:(注:BaO2中O显-1价,HgO中Hg显+2价)
①2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
②2BaO2+2H2O=2Ba(OH)2+O2↑
③2HgO![]() 2Hg+O2↑
2Hg+O2↑
④2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
若要制得相同物质的量的氧气,反应中电子转移数目之比为( )
A. 3:2:1:4 B. 1:1:1:1 C. 2:1:2:2 D. 1:2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,把试管放入盛有25 ℃饱和Ca(OH)2溶液的烧杯中,试管开始放入几小块镁片,再用滴管滴5 mL盐酸于试管中。请回答下列问题:

(1)实验中观察到的现象是________________________________。
(2)产生上述现象的原因是________________________。
(3)写出有关的离子方程式:_____________________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于,下同”)镁片和盐酸的总能量,ΔH________0。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数值。下列说法正确的是
表示阿伏加德罗常数值。下列说法正确的是
A. 标准状况下,2.24 LNO2与N204的混合气体中含有氮原子的数目为0.1![]()
B. 若1 L 0.2 mol/L的FeCl3溶液完全水解形成胶体,则胶体粒子数为0.2![]()
C. 标准状况下,22.4L SO2中含有的氧原子数为3.0![]()
D. 常温下,Na202与H20反应生成lmol02时,转移电子数是2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)几种共价键的键能如下表所示:
化学键 | O=O | H—H | O—H |
键能(kJ/mol) | 496 | 436 | 462 |
已知:O2(g)+2C(s)=2CO(g) △H= -220kJ·mol-1,则H2O(g)+C(s) = CO(g)+H2(g) △H=___ kJ·mol-1。
(2)200℃时,将物质的量均为1mol的CO2和C(s)加入2L的密闭容器中,在一定条件下发生反应:CO2(g)+C(s) ![]() 2CO(g) △H,平衡时CO的体积分数为40%。
2CO(g) △H,平衡时CO的体积分数为40%。
①下列事实能够说明该反应达到平衡状态的是____________。
a.混合气体的平均相对分子质量不变
b.该反应的△H不变
c. CO2和CO的生成速率相等
d.混合气体的密度不变
②达到平衡时CO2的转化率为__________________。
③若在300°C时,将物质的量均为lmol的CO2和C(s)加入1L的密闭容器中,平衡时CO的体积分数为50%,则该反应的△H_____0 (填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在众多的新能源中,氢气将会成为21世纪最理想的能源。如图所示,硫酸工业中产生的S02通过下列过程既能制得H2O,又能制得H2。

请回答:
(1)该过程中X 是_____________(写化学式)。
(2)写出该过程反应的化学方程式:I _________ ,II ______________ 。
(3)尾气中的S02可用NaOH溶液吸收,同时可得含Na2S03的样品,为测定样品中 Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):

①A装置发生反应的化学方程式 __________。
②装置D的作用是 _______________ 。
③持续通入氮气的目的_______________ 。
④甜定样品中的质量分数所需的数据除含Na2SO3的样品质量外,还需要测 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______,制得等量H2所需能量较少的是________。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=________%,反应平衡常数K=________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2_______α1,该反应的ΔH________0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入M (g)和N (g),发生反应M (g) +N (g) ![]() 2P (g) +Q (s),所得实验数据如下表:
2P (g) +Q (s),所得实验数据如下表:

下列说法正确的是
A. 实验①中,若5 min时测得n(N) = 0.050 mol,则0~5min时间内平均反应速率v(P) = 0.015 mo1/(L·min)
B. 实验②中达到平衡后,增大压强,M的转化率增大,平衡常数不变
C. 600℃时该反应的平衡常数K=3.0
D. 实验③中,达到平衡时,x<0.10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com