
【题目】用下列方程式均可制得氧气:(注:BaO2中O显-1价,HgO中Hg显+2价)
①2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
②2BaO2+2H2O=2Ba(OH)2+O2↑
③2HgO![]() 2Hg+O2↑
2Hg+O2↑
④2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
若要制得相同物质的量的氧气,反应中电子转移数目之比为( )
A. 3:2:1:4 B. 1:1:1:1 C. 2:1:2:2 D. 1:2:1:1
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A的质子数等于周期数,B与C的 P轨道均有三个成单电子,D的最高正价与最低负价代数和为4,E的最外层只有一个电子, 内层轨道处于全充满状态。试回答下列问题。
(1)基态E原子的电子排布式为_________;C和D的第一电离能较大的________(填元素符号)。
(2)DO32-中D原子的杂化类型为_________;A、D和氧元素组成的液态化合物A2DO4中存在的作用力有_____________。
(3)结构式为A—B=B—A的分子中σ键和π键的数目比为________;B2分子和NO+离子互为等离子体,则NO+的电子式为___________。
(4)向EDO4溶液中加入过量稀氨水,其化学方程式为_______________;产物中阳离子的配体是_____________(填化学式)。
(5)D(黑球)和E(白球)形成某种晶体的晶胞如图所示。已知该晶体的晶胞边长为516Pm,则黑球和白球之间最近距离为________pm(精确到0.1,已知![]() =1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。
=1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一、选用正确的实验操作,将下列各组物质进行分离或提纯。
A.分液B.过滤C.萃取D.蒸馏 E.蒸发结晶 F.高温分解
(1)分离CC14和H2O:________________(填字母,下同)。
(2)除去石灰水中的CaCO3:________________。
(3)除去CaO固体中少量的CaCO3固体: ________________。
(4)从碘水中提取碘:____________。
(5)分离乙醇(沸点为78 °C)和甲苯(沸点为110.6°C)的液体混合物:__________。
二、蒸馏是实验室制备蒸馏水的常用方法


图一 图二
(1)图Ⅰ是实验室制取蒸馏水的常用装置,图中明显的一个错误是____________________。
(2)仪器A的名称是______________,仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入几粒__________,其作用是防止液体暴沸。
(4)从锥形瓶取少量收集到的液体于试管中,然后滴入____________和____________(填试剂的化学式),检验是否存在氯离子。
(5)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是______________;烧杯中最好盛有的物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用100mL3mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)求原NaOH溶液的质量分数。
(2)求所得溶液中Cl-的物质的量。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制备MnO2的装置如图。下列说法错误的是

A. 离子交换膜可选用质子交换膜
B. 阳极反应式为Mn2++2H2O-2e-= MnO2+4H+
C. 阴极区溶液的PH增大
D. 导线中通过1mol电子时,理论上阳极区溶液质量减少44.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等分,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含有b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子浓度为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构的描述正确的是
A. 甲苯分子中的所有原子可能共平面 B. CH2=CH-C6H5分子中的所有原子可能共平面
C. 二氯甲烷分子具有正四面体结构 D. 正戊烷分子中5个碳原子可以在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2﹣与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式_____,F元素原子的电子排布式_____,E元素的原子结构示意图是_____;
(2)化合物乙中含有的化学键是_____;
(3)化合物甲的结构式_____,固体时属于_____晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象所表示的化学知识中不正确的是
A. 分散系的分类![]()
B. 稀释浓氢氧化钠溶液的过程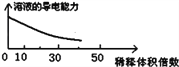
C. 向碳酸钠溶液中逐滴滴加盐酸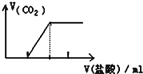
D. 向盐酸和氯化镁混合溶液中滴加氢氧化钠溶液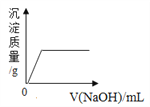
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com