
科目:高中化学 来源: 题型:
| A、2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ?mol-1 | ||
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ?mol-1 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.9 g Na2O2固体中所含的离子数为0.15NA,所含的共价键数为0.05NA |
| B、14 g C2H4和C3H6的混合物中,所含H原子数为3NA |
| C、PCl3、NO2、BF3、HClO这些分子中每个原子都达到了8电子稳定结构 |
| D、电解精炼铜时,当阳极减少3.2 g铜时,转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6 mol |
| B、在0.3~0.6 mol之间 |
| C、0.3 mol |
| D、小于0.3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的分子式为CH4 |
| B、甲烷中含有碳元素和氢元素 |
| C、甲烷中只含碳元素和氢元素 |
| D、甲烷的化学性质比较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
| B、Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
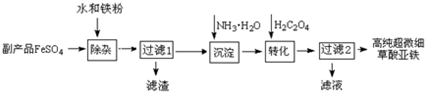
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+ NH4+ SCN- Cl- |
| B、Ba2+ H+ NO3- SO42- |
| C、Fe3+ Fe2+ Na+ NO3- |
| D、Fe2+ NH4+ Cl- OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com